

相关实验
实验承诺函
咨询记录
技术文章

城市
时间
江苏省苏州市
2025-04-15 03:49:33
安徽省
2025-04-14 23:49:12
安徽省
2025-04-14 11:50:12
河南省开封市
2025-04-14 00:11:20
安徽省
2025-04-13 17:42:52
浙江省温州市
2025-04-13 13:33:32
安徽省
2025-04-13 09:33:18
江苏省苏州市
2025-04-13 05:33:04
浙江省丽水市
2025-04-12 16:31:05
江苏省南通市崇川区
2025-04-12 11:49:58
实验介绍
【应用简介】
衰老细胞的形态变化主要表现为形状变大、变平、胞核增大、核膜内陷、染色质固缩、胞内溶酶体变多等。衰老细胞中细胞器数量尤其是线粒体数量减少,胞质内有色素堆积和空泡形成,最终导致细胞死亡。总体来说衰老细胞的各种结构呈退行性变化。根据其特征,目前常用β-半乳糖苷酶活性检测衰老。
【技术原理】
衰老细胞或组织产生的β-半乳糖苷酶可以催化底物X—Gal,生成深蓝色产物,从而在光学显微镜下很容易观察到。在人体表皮角质层细胞中,也可以发现SA-β-gal随年龄的增加而增加。并且,SA-β-gal不依赖于DNA复制,可以区分衰老细胞与静止期的细胞。
【实验方法】
Step1:细胞培养
Step2:细胞转染或药物处理
Step3:处理结束后进行细胞β-半乳糖苷酶检测
Step4:200x镜下观察
案例展示
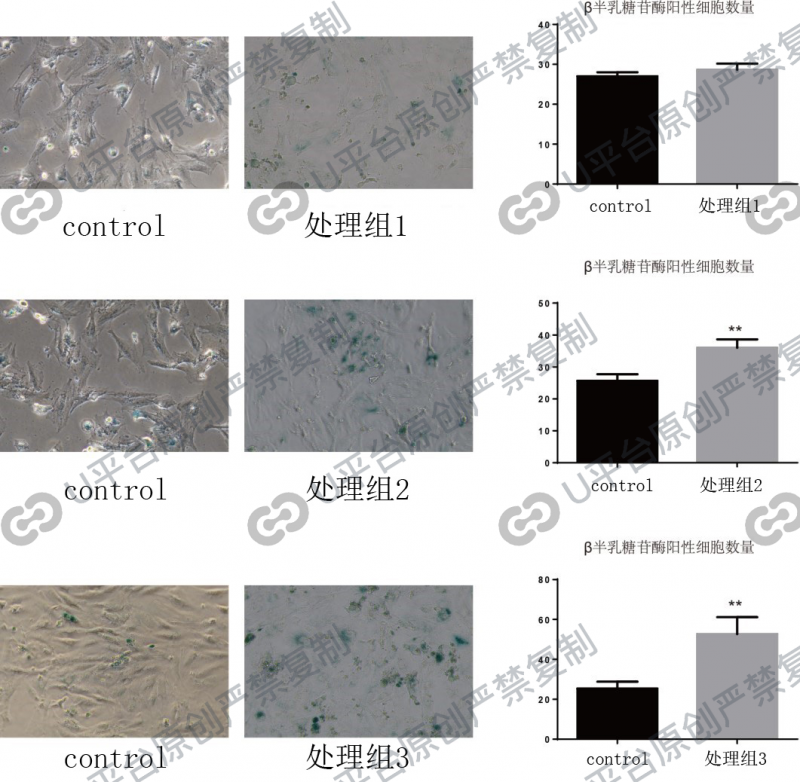
经过处理后,细胞衰老程度显著增加。
技术总结
细胞在体外培养时,会随着传代次数的增加,衰老情况随之增加,表现为衰老细胞增多或细胞更容易衰老。因此,在细胞传至20代左右时,可取一部分细胞进行β-半乳糖苷酶染色分析,发现阳性结果即诱导成功。如染色不理想,则可增加外部因素处理,如不同浓度的双氧水,处理时间可自己选择,但不宜过长。外部因素处理后,可从中选取部分细胞进行染色分析。或者,在细胞铺板培养过程中,提高细胞的接种密度,同时使用无血清的培养基进行培养,一样选择部分细胞进行染色分析。以上操作可交替进行。直至出现染色阳性结果。
送检与交付标准
| 样品类型 | 样品需求 | 保存条件 | 运输条件 | 备注 |
|---|---|---|---|---|
| 冻存细胞 | 1.取对数生长期的细胞,消化离心收集细胞,加入冻存液吹打混匀,装入冻存管,标明细胞名称/细胞代数,冻存细胞数量在1-5*106个/ml。 2.项目启动后细胞复苏,复苏后3天反馈细胞状态,3-5天反馈细胞污染情况,5-7天反馈支原体污染情况。 3. 细胞详细信息(名称、培养基和其他培养条件等,如经过特别处理需告知并提供必要的信息) | 液氮 | 干冰 | 所有样本均须有唯一标记,且标记清晰可识 |
| 复苏后细胞 | 1.使用T25培养瓶运输。细胞汇合度达到60%以上,装满培养液,只留纽扣大小的气泡,瓶口用封口膜封好,标明细胞名称/细胞代数/接种时间/培养基类型,瓶子固定运输。 2.收到细胞后3天反馈细胞状态,3-5天反馈细胞污染情况,5-7天反馈支原体污染情况。 3. 细胞详细信息(名称、培养基和其他培养条件等,如经过特别处理需告知并提供必要的信息) | 常温 | 常温 | |
| 质粒 | 1.纯度高,无内毒素,无蛋白质,基因组DNA/RNA污染,质粒A260:A280的比值在1.8-2.0之间 2.浓度不低于0.5μg/μl,总量大于100μg,无内毒素处理 3. 载体详细信息,包括名称、大小、抗性、荧光标记 | -20℃ | 冰袋 | |
| 病毒 | 1.慢病毒:滴度不低于1*108TU/ml,体积约200μl,标明制备时间,且没有反复冻融 2.腺病毒:滴度不低于1*109PFU/ml,体积约200μl,标明制备时间,且没有反复冻融 3.明确是否表达荧光标签蛋白及其种类,最好需要提供病毒载体图谱; | -80℃ | 干冰 |

