

相关实验
实验承诺函
咨询记录
技术文章

城市
时间
山东省
2025-04-15 06:10:52
湖北省
2025-04-15 00:46:01
江苏省南通市崇川区
2025-04-14 23:36:00
浙江省温州市
2025-04-14 17:20:18
河南省开封市
2025-04-14 12:17:18
北京市
2025-04-13 12:43:35
江苏省
2025-04-13 10:10:52
上海市
2025-04-13 08:35:22
江苏省苏州市
2025-04-13 02:24:14
江苏省南通市崇川区
2025-04-12 21:51:48
实验介绍
【应用简介】
在细胞实验中,对于按常规方法难以转染甚至无法转染的细胞,通过使用病毒介导的方式能够大大提高基因的转导效率,达到目的基因高效表达的目的。
具体来说,慢病毒包装主要应用于以下几个方面:
1、对于难转染的细胞,如原代细胞、干细胞、不分化的细胞等,能大大提高目的基因转导效率,而且目的基因整合到宿主细胞基因组的几率大大增加,极大地方便了RNAi,cDNA克隆以及报告基因的研究;
2、进行稳转细胞株的筛选;
3、为活体动物模型实验提供高质量的包含目的基因的病毒液。
【技术原理】
慢病毒表达载体包含了包装、转染、稳定整合所需要的遗传信息。慢病毒包装质粒可提供所有的转录、包装、重组的假病毒载体所需要的所有辅助蛋白。为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装。包装好的假病毒颗粒分泌到细胞外的培养基中。离心收集上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
【实验方法】
1、细胞准备:细胞传到后,密度达到70%左右时进行转染;
2、细胞转染:取两个EP管,一个加入Opti-MEM、核心质粒和包装质粒;另一个加入Opti-MEM、lipo2000,然后将两管混匀;
3、细胞孵育:将混合液逐滴加入细胞培养皿中,混匀后孵育;
4、收集病毒:转染后48h、72h收集含慢病毒的上清;
5、滴度检测:细胞为30%-50%时加入病毒上清液,检测阳性细胞比例。
案例展示
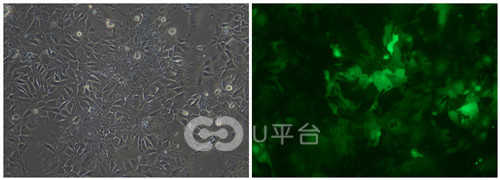
慢病毒感染的细胞(左:白光;右:荧光)
技术总结
1、获取的目的基因一定要精确(注:客户提供基因ID);
2、针对目的基因设计合成shRNA建议设计3对,以保证效果,节省实验周期;
3、要选择符合要求的载体;
4、构建的过慢病毒载体需要经过测序验证;
5、对于测序正确的重组质粒,需要提取和纯化高质量的不含内毒素的重组质粒;
6、使用高效重组载体和包装质粒共转染293T细胞,进行病毒包装并收集上清液;
7、通过超滤和超速离心浓缩和纯化病毒;
8、建议病毒使用前先测定病毒滴度。
送样与交付标准
| 样品类型 | 样品需求 | 保存条件 | 运输条件 | 备注 |
|---|---|---|---|---|
| 冻存细胞 | 1.取对数生长期的细胞,消化离心收集细胞,加入冻存液吹打混匀,装入冻存管,标明细胞名称/细胞代数,冻存细胞数量在1-5*106个/ml。 2.项目启动后细胞复苏,复苏后3天反馈细胞状态,3-5天反馈细胞污染情况,5-7天反馈支原体污染情况。 3. 细胞详细信息(名称、培养基和其他培养条件等,如经过特别处理需告知并提供必要的信息) | 液氮 | 干冰 | 所有样本均须有唯一标记,且标记清晰可识 |
| 复苏后细胞 | 1.使用T25培养瓶运输。细胞汇合度达到60%以上,装满培养液,只留纽扣大小的气泡,瓶口用封口膜封好,标明细胞名称/细胞代数/接种时间/培养基类型,瓶子固定运输。 2.收到细胞后3天反馈细胞状态,3-5天反馈细胞污染情况,5-7天反馈支原体污染情况。 3. 细胞详细信息(名称、培养基和其他培养条件等,如经过特别处理需告知并提供必要的信息) | 常温 | 常温 | |
| 质粒 | 1.纯度高,无内毒素,无蛋白质,基因组DNA/RNA污染,质粒A260:A280的比值在1.8-2.0之间 2.浓度不低于0.5μg/μl,总量大于100μg,无内毒素处理 3. 载体详细信息,包括名称、大小、抗性、荧光标记 | -20℃ | 冰袋 | |
| 病毒 | 1.慢病毒:滴度不低于1*108TU/ml,体积约200μl,标明制备时间,且没有反复冻融 2.腺病毒:滴度不低于1*109PFU/ml,体积约200μl,标明制备时间,且没有反复冻融 3.明确是否表达荧光标签蛋白及其种类,最好需要提供病毒载体图谱; | -80℃ | 干冰 |
交付标准:
滴度:>108TU/ml
规格:1ml
赠送阴性对照病毒规格:0.2ml(>108TU/ml)
