

相关实验
实验承诺函
咨询记录
技术文章

城市
时间
江苏省
2025-04-14 18:50:37
北京市
2025-04-14 18:17:32
安徽省
2025-04-14 17:46:10
江苏省南通市崇川区
2025-04-14 15:16:41
江苏省南通市崇川区
2025-04-14 15:12:33
安徽省
2025-04-14 11:45:52
江苏省
2025-04-13 20:00:08
江苏省南通市崇川区
2025-04-13 18:36:50
江苏省南通市崇川区
2025-04-13 17:42:51
江苏省
2025-04-13 14:36:25
实验介绍
【鉴定方法】
基于SEC+超滤的外泌体分离方法,可方便快捷进行高纯度及高回收率的外泌体分离。以荧光外泌体作为标准品,Exosupur可回收94.87%的荧光外泌体;能够去除99.44%的血浆游离杂蛋白,如主要的miRNA结合蛋白Ago、血浆杂蛋白HAS在Exosupur中更少;跟超离及市面常见试剂盒相比,该方法提取的外泌体的particle数与蛋白含量比值更高,表明分离得外泌体纯度更高,杂蛋白含量更低。
MISEV2018(细胞外囊泡杂志)对外泌体的表征规定了最小试验要求:
① 总体表征:
至少3个阳性(至少包括1个跨膜蛋白和1个细胞溶质蛋白)、1个阴性蛋白质标志物。
② 个体表征:
电镜或原子力显微镜、单颗粒追踪两种方法互为补充。
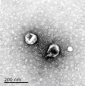
1、电镜检测
透射电子显微镜观察法(TEM)是从形态和大小上对外泌体进行鉴定。通过负染的方法,在高倍放大下直接观察单个外泌体的形态结构和大小。
检测仪器:透射电子显微镜(HITACHI,H-7650)
样本要求:BCA浓度300-400ng/μl,体积10μl;避免反复冻融,4℃保存,冰袋运输。
结果呈现:


2、粒径检测
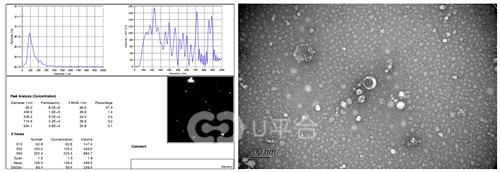
粒径分析是从整体上对外泌体大小的分布情况进行检测,具有准确、快速、重复性好等优点,是对现有外泌体鉴定方法的良好补充。
检测仪器:Particle Metrix(ZetaView)
样本要求: 避免反复冻融,4℃保存,冰袋运输。
结果呈现:
样本名称 | 平均粒径(nm) | 粒径主峰(nm) | 主峰所占百分比(%) | 浓度 (Particles / mL) |
血浆 | 105.7 | 85.5 | 99.2 | 1.0E+8 |
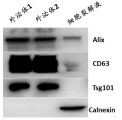
3、Western Blot检测
Western blot是通过抗原抗体特异性结合的原理,对外泌体标志蛋白进行检测,从蛋白质层面对外泌体进行鉴定。常用的外泌体标志蛋白包括CD63、TSG101及Alix等。
检测方法:ECL化学发光,传统胶片曝光或者专用曝光仪器。
样本要求:血浆样本BCA量60ug,>0.5μg/μl;细胞上清BCA量40μg,>0.5μg/μl;冰袋运输。
结果呈现:
案例展示
技术总结
【常见问题】
1、血浆电镜图片为什么背景那么杂?
答:血浆中杂蛋白如糖蛋白、铁蛋白,低密度脂蛋白等粒径大小与外泌体非常接近,且
含量偏高,现有的分离方法无法完全剔除,所以会出现有一些杂蛋白背景。
2、CD63 条带为什么呈弥散状?这样发文章能用吗?
答:由于 CD63 的糖基化水平不同,导致其条带呈弥散状,这是蛋白本身的特点,所以不会
影响文章的发表。
送检与交付标准
【送检标准】
(一)、血浆样本采集
1、请用EDTA抗凝管采集患者血液(a),若不能第一时间处理,请于4℃临时保存(不得超过4 h);
2、将采集到的血液在4℃下1500 g,离心20 min,去除血液中的细胞;
3、取上清,4℃下3000 g,离心15 min,收集上清(血浆),-80℃保存。
4、送样量: 排阻+超滤 4mL(够2次分离)
超离 4mL
注意事项:①请勿使用含肝素抗凝剂的采样管收集盛放;②请排除乙肝病毒,HIV等病毒感染样本。
(二)、血清样本采集
1、请用EDTA抗凝管采集患者血液(a),若不能第一时间处理,请于4℃临时保存(不得超过4 h);
2、将采集到的血液在4℃下1500 g,离心20 min,去除血液中的细胞;
3、取上清,4℃下13000 g,离心2 min,收集上清(血清),-80℃保存。
4、送样量: 超离 4 mL
排阻+超滤 1mL
注意事项:请排除乙肝病毒,HIV等病毒感染样本。
(三)、尿液样本采集
1、采集前/中后段晨尿约60 mL,若不能第一时间处理,请于4℃临时保存(不得超过8 h);
2、将采集到的尿液在4℃下(室温亦可)离心2000 g,20 min,去除尿液中的细胞;-80℃保存;
3、送样量:60 mL。
注意事项:请务必嘱咐患者,①采集晨尿,或6 h以上未排尿亦可;②中段尿请务必去掉最初排出的50-80 mL尿液;③女性受试者,请于采尿前对外阴进行清洗。
(四)、胸水样本采集
1、临床收集胸水后若不能第一时间处理,请于4℃临时保存(不得超过8 h);
2、将收集到的胸水1000 g离心10 min,收集上清液;
3、将得到的胸水上清3000 g离心10 min,收集上清,-80℃保存。
4、送样量:30 mL
(五)、腹水样本采集
1、临床收集腹水后若不能第一时间处理,请于4℃临时保存(不得超过8 h);
2、将采集到的腹水在4℃下(室温亦可)离心2000 g,20 min,去除腹水中的残渣;-80℃保存;
3、送样量:30 mL。
(六)、脑脊液样本采集
1、采集方式为腰椎穿刺,样本一经分离,请务必立即置于冰上或4℃短暂保存(不得超过4 h),采样时注意避免血液污染;
2、样本室温下2000 g离心20 min去除细胞及部分碎片,取上清,-80℃保存;
3、送样量:5 mL。
注意事项:请勿使用含肝素抗凝剂的采样管收集盛放。
(七)、胆汁样本采集
1、用无菌容器收集胆汁;
2、将收集到的胆汁在4℃下,3000 g离心10 min去除细胞沉渣和碎片;
3、收集胆汁上清液,4℃或者-20℃长期保存;
4、送样量:5 mL。
(八)、细胞样本采集
对于耐受无血清培养的细胞的处理流程:
1、细胞培养:对于贴壁细胞汇合密度在70%以上,用PBS洗涤细胞2-3遍去除残留牛血清,添加无血清培养基,继续培养24小时;
2、上清收集:细胞上清先用200-300g离心10min,再用3000g离心10min,最后0.22um过膜或者10000g离心30min。将处理后的细胞上清经100kd超滤管超滤浓缩(详见参考文献2.1);
3、储存运输:将处理好的细胞上清收集在无菌培养瓶,-80保存或者干冰运输,体积需求细胞上清原液大于200ml(对应于10cm的大皿,至少需要20大皿);
4、对于一些状态良好的细胞上清,少至70ml,也可以得到较好的外泌体分离结果。
对于不耐受无血清培养的细胞的处理流程:
1、细胞培养:对于贴壁细胞汇合密度在70%以上,用PBS洗涤细胞2-3遍去除残留牛血清,添加含5%无外泌体血清的培养基,继续培养24小时;
2、上清收集:细胞上清先用200-300g离心10min,再用3000g离心10min,最后0.22um过膜或者10000g离心30min。将处理后的细胞上清经100kd超滤管超滤浓缩(详见参考文献2.1);
3、储存运输:将处理好的细胞上清收集在无菌培养瓶,-80保存或者干冰运输,体积需求细胞上清原液大于200ml(对应于10cm的大皿,至少需要20大皿);
4、对于一些状态良好的细胞上清,少至70ml,也可以得到较好的外泌体分离结果。
5、送样量:细胞上清原液建议大于200 mL。
注:细胞上清样本按照送样体积收费,超滤浓缩步骤可选择自己完成也可直接送公司完成。
参考文献:Rong Xu, David W. Greening , Alin Rai, Hong Ji, Richard J. Simpson. Highly-purified exosomes and shed microvesicles isolated from the human colon cancer cell line LIM1863 by sequential centrifugal ultrafiltration are biochemically and functionally distinct. Methods. 2015 .1;87:11-25
【交付标准】

