

15分文章教你研究选择性自噬的起始【附视频课程】
 2021-04-28 18:26:50
2021-04-28 18:26:50
来源/作者:普拉特泽生物-医学整体课题外包

俗话说得好“抛开时空谈分子机制是不现实的”,就像古希腊大哲人赫拉克利特说“人不能两次踏进同一条河流”一样,生命体中的所有物质都是流动的,所以在进行科学研究的时候也不能忽略这一点。
今天就给大家带来一篇研究细胞选择性自噬起始到结束过程中时空有序性调节的文章。该文发表于Molecular Cell,2019年IF:15.5。
老规矩,思路图奉上
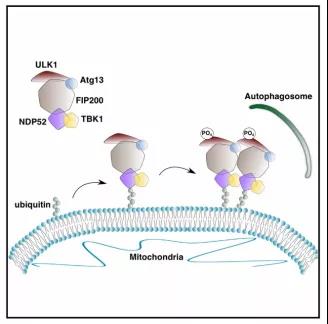
当我们开篇就看到这张思路图时不禁会疑惑:
这文章不是研究自噬的吗?
图里怎么没有自噬小体的经典结构出现呢?
我们来看Highlights:
Highlights:
1、NDP52/TBK1以ULK1为靶标,在没有LC3的情况下启动自噬。
2、自噬受体TBK1的磷酸化促进NDP52通过FIP200与Atg13/ULK1复合体结合。
3、ULK1在底物上被激活,与AMPK和mTOR活动无关。
4、异位募集FIP200结合肽足以对底物进行自噬性降解。
原来如此,本文发现了一个不依赖于LC3的自噬启动途径,而且大部分探讨的是自噬这整个过程的起始阶段,即如何精准靶向需要被降解的细胞器(本文是线粒体),促使线粒体上选择性自噬体的形成。
Background:
都知道自噬对于细胞内各种成分的大量降解和细胞内稳态至关重要。但少有研究阐明自噬小体可以围绕特定的亚细胞结构(如线粒体等细胞器)进行选择性降解,即选择性自噬。
虽然涉及许多ATG蛋白的自噬小体形成的精心安排的步骤已经被阐明,然而目前还没有明确的机制阐明是如何将底物识别与自噬的生物发生联系起来,也不确定是什么提供了靶向指示效应来使早期的自噬小体在细胞器附近形成从而让这些细胞器被指定为即将被自噬性降解的。
已知ULK1复合体是自噬小体生物发生过程中最上游的机制,由ULK1激酶、FIP200、ATG13和ATG101组成。但目前尚不清楚ULK1在选择性自噬过程中是如何被激活的。本文所要探讨的,就是选择性自噬形成的早期阶段。
Results:
Fig1:化学诱导蛋白定位法研究NDP52介导的有丝分裂吞噬作用
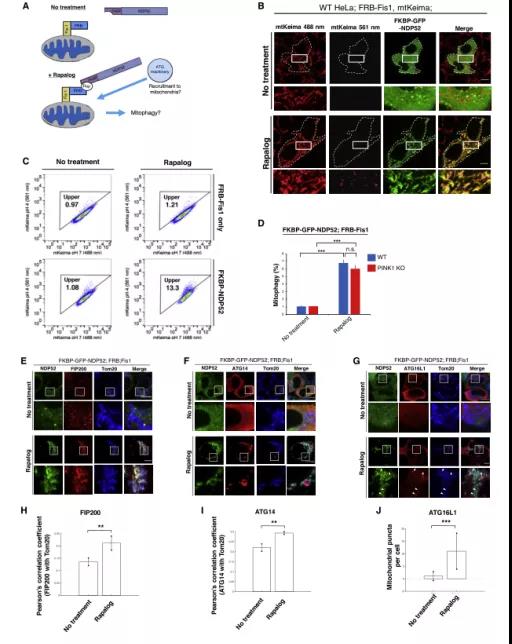
作者为了分离NDP52在自噬小体生物发生中的作用,用了一种在不干扰细胞代谢的情况下,通过诱导FKBP和FRB二聚化的化合物,将NDP52定位到线粒体上的化学诱导法(图1A),可以通过成像(图1B)和流式分析(图1C)检测到线粒体出现线粒体溶酶体。
在去极化诱导的线粒体自噬过程中,NDP52(一种自噬受体)和其他一些自噬相关蛋白被招募到线粒体。将NDP52定位于PINK1KO(PINK1 knock out)细胞中的线粒体发现,在线粒体形成方面与KO组WT细胞没有差异(图1D)。因此,NDP52的异位募集可以独立于PINK1/Parkin通路诱导线粒体自噬。NDP52的线粒体定位可招募ATG蛋白:FIP200、ATG14和ATG16L1(图1E-1J)。ATG14和ATG16L1位于FIP200下游,参与自噬小体的成熟。这些结果表明,NDP52的靶向引导足以动员ATG蛋白启动选择性自噬。
总的来说,fig.1论证了:
NDP52可以靶向底物复合物启动ATG,当定位于线粒体时,NDP52可以直接启动线粒体自噬并招募各种ATG蛋白,这表明NDP52可能与线粒体自噬的生物发生相互作用。
Fig2: NDP52通过FIP200与ULK1复合物相互作用
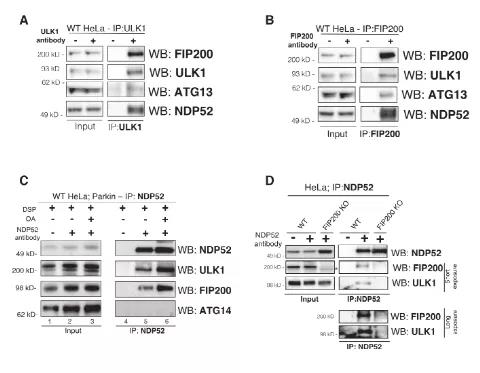
接着,作者就继续探讨并揭示了内源性NDP52会与内源性ULK1复合物:ULK1激酶、ATG13和FIP200结合(图2A、B)。
此外,NDP52与ULK1复合物的结合在Parkin介导的线粒体自噬,NDP52与ULK1复合物的结合具有一定的特异性(图C),因为在FIP200 KO(FIP200 knock out)细胞中,NDP52不再与ULK1结合,表明NDP52需通过FIP200与ULK1复合物结合(图2D)。
Fig3: NDP52-FIP200相互作用的功能分析
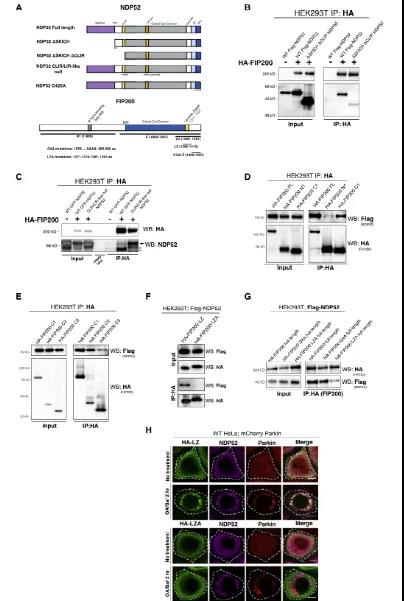
为了证实NDP52和FIP200的相互作用,作者进行了突变定位验证(图3 A)。NDP52(SKICH结构域)的缺失抑制了NDP52与FIP200的结合(图3B),比较FIP200截断突变体发现,只有FIP200的C-末端与NDP52有亲和力(图3C-D)。
