亲爱的宝子们,熊汉三又又又来啦,端午节吃粽子、看龙舟赛了嘛?上个月为大家分享了Nature文章,今天我又为大家带了一篇来自cell(IF=66.850)的文章,也是四大顶刊之一,和上个月分享的nature文章影响因子不相上下呢,快来学习吧!!相信大家对于新冠一定都不陌生,毕竟也接触3年之久了,从最开始的全民恐慌,到现如今大家能平常心对待,大家都经历颇多,最近还经常听到大家说又复阳了,现在都转阴了嘛。对于新冠感染的后遗症也是众说纷纭,但是你们真的了解这个后遗症嘛,今天就让我们跟着这篇高分文章一起学习下,后遗症中的一种——认知障碍。Mild respiratory COVID can cause multi-lineage neural cell and myelin dysregulation.由于COVID-19幸存者经常出现挥之不去的神经系统症状,类似于癌症治疗相关的认知障碍,一种以白质小胶质细胞反应性和随之而来的神经调节障碍为核心的综合征,因此作者基于这种情况针对感染COVID之后所导致的认知障碍进行研究。
首先,在临床和动物水平验证感染COVID病毒是否引起神经炎症
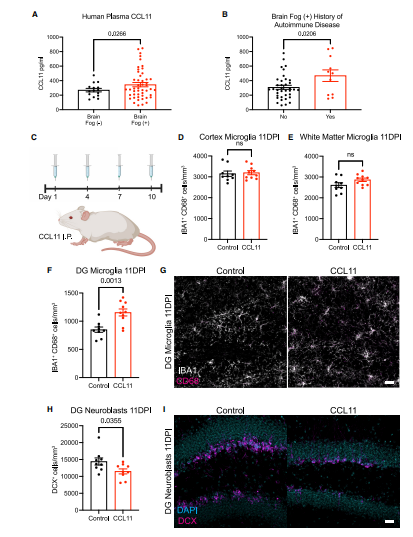
通过构建SARS-COV-2感染的小鼠模型进行实验(图1A),感染后小鼠未表现出体重减轻或其他可观察到的疾病行为(图1B)。免疫荧光实验显示,SARS-CoV-2感染7天后的脑组织中未检出病毒(图1C)。而在感染7天和7周时,血清和脑脊液(CSF)中的细胞因子谱显著升高(图1D-G)。感染7天后,CSF细胞因子和趋化因子升高(图1F和1H)。其中,CSF中的CXCL10、CCL7、CCL2、CCL11 、GMCSF 、IL10和CCL5在感染7周后仍升高(图1G和1L)。与感染7天相比,感染7周脑脊液中CCL11水平进一步升高(图1J)。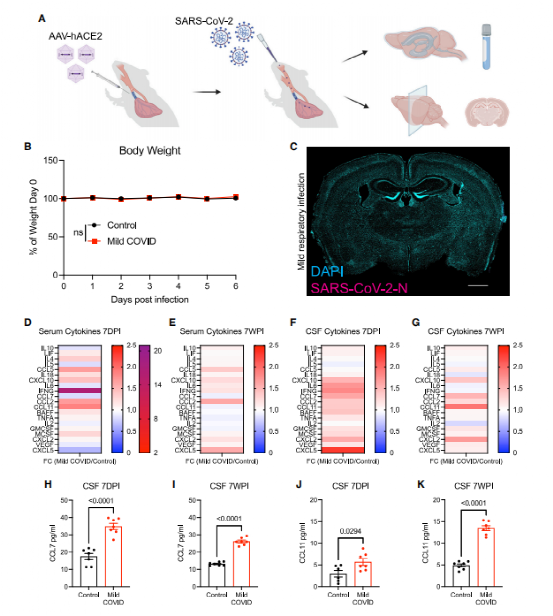
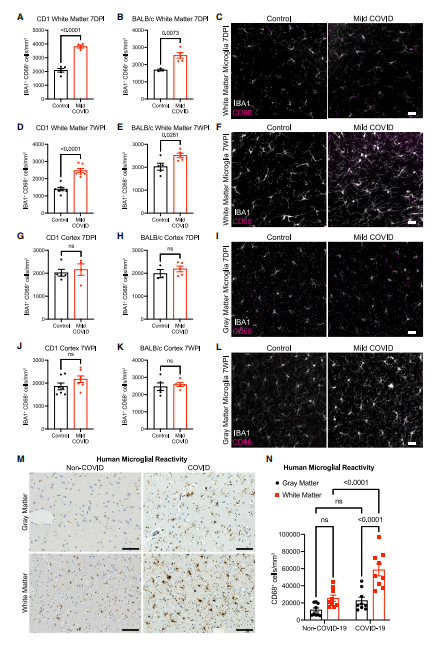
随后通过IBA1和CD68共阳性评估皮质下白质的小胶质细胞/巨噬细胞反应性(图2)。在两个不同小鼠株(CD1和BALB/c)感染7天后,皮质下白质特异性小胶质细胞/巨噬细胞反应性明显增加(图2A-2C),并持续至感染后7周(图2D-2F)。与皮质下白质相比,在皮质灰质中未观察到小胶质细胞/巨噬细胞反应(图2G-2L)。而后通过采集人鼻拭子,发现与未感染SARS-CoV-2的个体相比,皮质下白质中CD68+小胶质/巨噬细胞反应性显著升高。
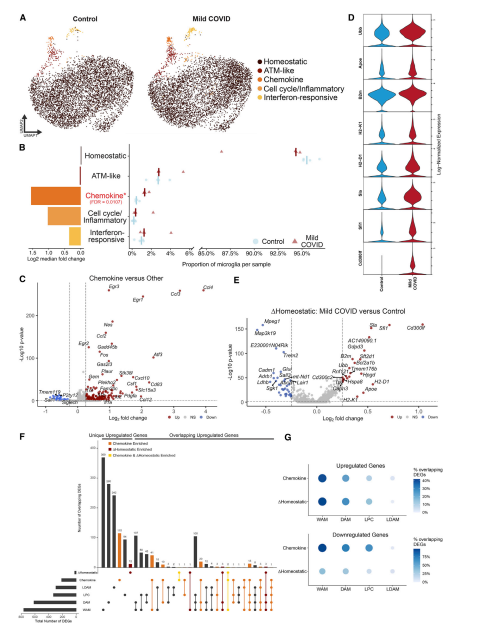
其次通过对轻度呼吸道SARS-CoV-2感染7天后的皮质和白质小胶质细胞进行了单细胞RNA测序。通过单细胞测序揭示了五种不同的小胶质细胞状态(图3A)。虽然在对照小鼠和轻度COVID-19感染后的小鼠中均可检测到5种不同的小胶质细胞状态,但COVID-19感染后小鼠中富集趋化因子的小胶质细胞丰度增加(图3B),其特征是表达几种趋化因子和细胞因子,如TNF、IL-1a和IL-1b,符合炎症反应特征(图3C)。与对照相比,COVID-19感染后小鼠的稳态小胶质细胞簇内的转录发生了变化,炎症、参与抗原处理和呈递的基因以及细胞表面糖蛋白Cd300lf的表达增加(图3D-E)。对趋化因子和改变的稳态基因标签与之前特异性反应性小胶质细胞状态进行比较发现,来自趋化因子和改变的稳态基因标签的上调和下调基因与其他小胶质细胞状态之间有高度重叠,感染COVID-19后小胶质细胞的两个标签与WAM和DAM状态显示出最大的相似性(图3F-G)。
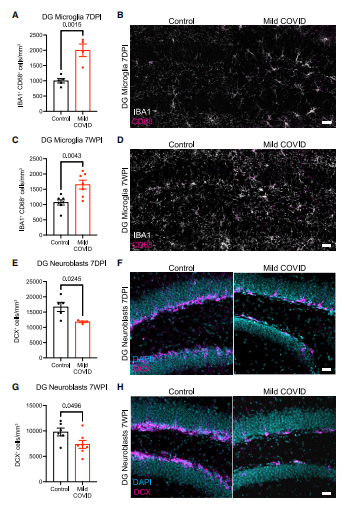
在轻度呼吸道感染COVID-19后检查小鼠海马体,我们发现在感染7天后,海马白质内的小胶质细胞/巨噬细胞反应性稳定增加(图4A-B),这种反应持续至感染后7周(图4C-D),在感染7天后,通过 Doublecortin阳性细胞定量分析,发现新神经元生成明显减少(图4E-F),并持续至感染后7周(图4G-H)。
COVID-19表现出认知功能障碍或“脑雾”的患者血浆中的CCL11水平高于COVID -19无认知障碍症状的患者(图5A),且有自身免疫病病史患者的CCL11水平高于无病史的患者(图5B)。在10天期间腹腔内给予4剂CCL11(图5C),系统性CCL11在海马白质中特异性诱导小胶质细胞/巨噬细胞反应(图5F和5G),而在皮质或皮质下白质中未诱导(图5D和5E)。还发现全身给予CCL11后海马神经发生减少(图5H和图5l)。
进一步探讨轻度呼吸道COVID对少突胶质细胞谱系细胞的影响。
检查了皮质下白质(胼胝体的扣带)中的少突胶质细胞谱系细胞,发现在轻度COVID-19感染7天后,PDGFRa标记的少突胶质前体细胞群无显著变化(图6A)。然而,截至感染7周后,少突胶质前体细胞数量明显轻度减少(约10%)(图6B-C)。通过ASPA和CC1免疫反应性结果显示,成熟少突胶质细胞显示出较大程度的耗损(图6D- F),到感染7天后出现约1/3 的少突胶质细胞丢失(图6D)。成熟少突胶质细胞的这耗竭持续至感染后7周(图6E)。在感染7天后,皮质下白质(胼胝体的扣带)有髓轴突密度明显降低(图6G-6l)。髓鞘丢失持续至感染后7周,并且髓鞘丢失的程度与甲氨蝶呤化疗暴露后4周(图6J)和6个月(图6K)时的髓鞘丢失相似。皮质下投射的髓磷脂的这种持续丢失将损害神经环路功能和轴突健康,从而加重COVID-19感染的众多有害神经生物学后果。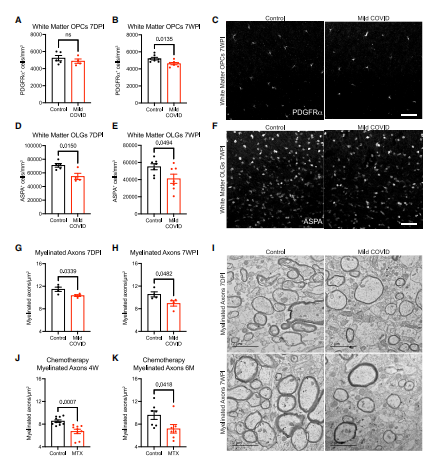
构建了呼吸道H1N1流感感染小鼠模型,该模型仅引起轻微的疾病行为,伴有轻度体重下降(图7A和7B)和血清细胞因子/趋化因子升高(图7C和7D)。H1N1流感感染7天后对CSF细胞因子的检查显示,数种细胞因子/趋化因子升高,包括IFN-y、CCL11、CCL2和GMCSF,以及IL4和CCL5明显升高(图7G)。H1N1流感感染7周时,唯一保持升高且实际上较感染7天的时间点升高的趋化因子是CCL11(图7E-7G)。然而,在H1N1感染7周后未升高的其他细胞因子/趋化因子在感染7天时升高,如TNF-α、IL-6、IL-2、CXCL5和IL-18等(图7E-7G)。在感染7天后,在皮质下和海马白质中发现白质选择性小胶质细胞/巨噬细胞反应性增加(图7H-I)。感染7周时,皮质下白质的小胶质细胞反应已恢复正常(图7J)。相比之下,小胶质细胞/巨噬细胞的反应性在7周时持续存在于海马白质中(图7K),在CSF中CCL11水平持续升高(图7F),皮质下白质中的少突胶质细胞在感染7天时减少(图7L),但在感染7周时随着小胶质细胞反应消退而恢复(图7M)。在第7天和第7周的时间点,海马神经发生减少,这与海马小胶质细胞/巨噬细胞的持续性反应一致(图7N-O)。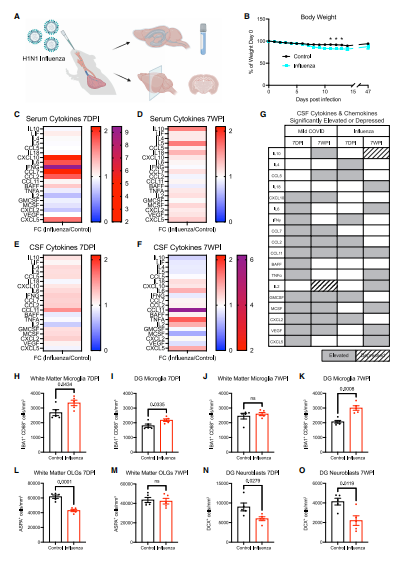
现在我们再来看看文章,在机制轴上研究不深,总的来说就是患有COVID-19的轻度呼吸道感染,也会导致持续的神经炎症变化,并由此导致对健康认知功能很重要的神经细胞类型的失调,而这些神经炎症变化——特别是白质选择性/富集的小胶质细胞反应——与海马神经发生受损、少突胶质谱系失调和其他疾病背景下髓鞘丢失有关。大家是不是疑惑为啥人家没有对机制轴进行深入研究也能发表在四大顶刊之一的期刊上呢,让我们来仔细品品文章的实验方法:构建了COVID-19感染动物模型以及神经侵袭性COVID动物模型,且为了研究皮质和白质小胶质细胞进行了单细胞测序,将小胶质细胞分类进行研究,这研究难度和新颖性蹭蹭的就上来啦,有需要的老师也可以借鉴借鉴喔本月文献分享到这就结束了哦!感兴趣的小伙伴们赶紧戳个关注呦,请继续期待我们下个月的有趣的文献及神刊文献解读吧~


 2023-06-29 14:00:54
2023-06-29 14:00:54








