

【国自然研究热点】之可变剪切(二)
 2023-02-14 15:30:17
2023-02-14 15:30:17
来源/作者:普拉特泽-生物医学整体课题外包平台
普拉特泽生物继续给广大科研人员分享国自然基金热门课题中——可变剪切的文献,普拉特泽生物提供生物医学课题申报咨询与协助服务!

本期文章题目:
《HNRNPC impedes m6A-dependent anti-metastatic alternative splicing events in pancreatic ductal adenocarcinoma》于2021年在Cancer Letters杂志上发布,影响因子为9.756,那m6A和可变剪切会碰撞出什么不一样的火花呢,让我们拭目以待。

Fig 1 HNRNPC是转移性PDAC患者的一个潜在的预后因素
数据库基因表达水平分析显示,HNRNPC在PDAC组织中显著过表达(均为P < 0.05,图1A-E)。此外,收集临床样本检测发现,HNRNPC在肝转移性PDAC组织中的表达显著高于非转移性PDAC组织(P < 0.01,图1F和G)。Kaplan-Meier曲线显示,HNRNPC高表达的PDAC患者的总生存期明显低于HNRNPC低表达的PDAC患者
(log-rankP<均为0.05,图1H和1I)。HNRNPC高表达患者的肝转移率明显高于HNRNPC低表达患者(log-rank P = 0.008,图1J)。这些结果突出了HNRNPC在PDAC中的潜在临床价值。
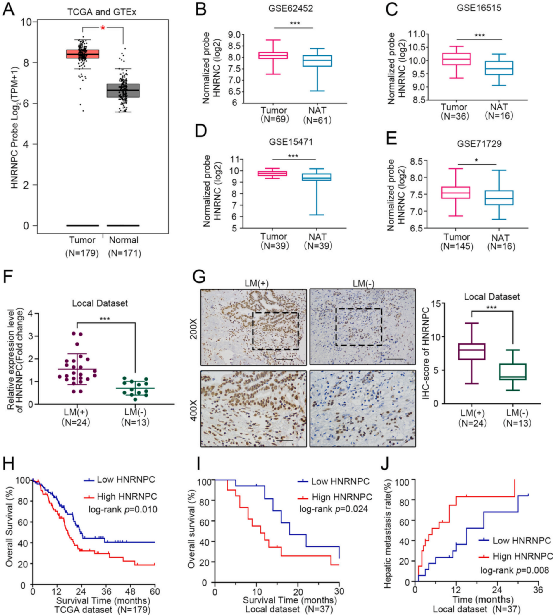
图1
Fig 2-3 HNRNPC增强体外PDAC细胞侵袭,促进体内PDAC肝转移
为了研究HNRNPC在PDAC中的作用,在PANC-1和CFPAC-1细胞中敲除HNRNPC(图2A和2C),通过Transwell检测发现侵袭性降低(图2E和F)。相比之下,过表达HNRNPC(图2B和2D)促进了PDAC细胞的侵袭性(图2E和2F)。为了进一步确定HNRNPC在体内对PDAC的影响,将PDAC细胞(包括sh HNRNPC-PANC-1细胞及其对照细胞)原位注射到裸鼠胰腺中(图3A)。8周后,荧光成像显示原位胰腺肿瘤的强度无显著差异(图3B和3C)。但shHNRNPC组的转移灶强度明显低于对照组(图3D)。这些结果表明,HNRNPC增强PDAC细胞侵袭,促进PDAC肝转移。
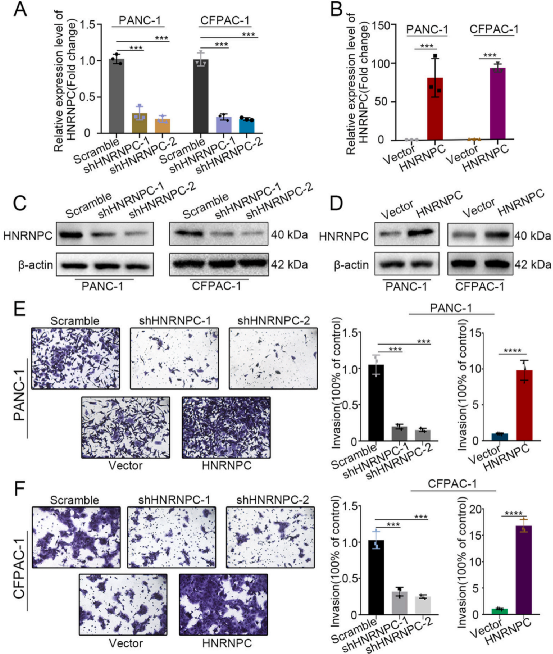
图2
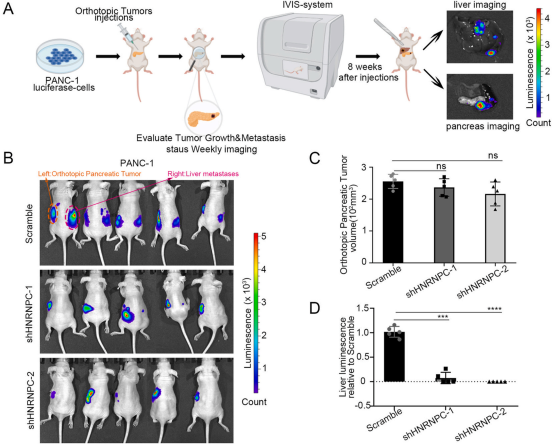
图3
Figure 4 HNRNPC调控了PDAC中TAF8的选择性剪接
为了进一步阐明HNRNPC促进PDAC细胞侵袭性的机制,作者采用RNA测序的方法检测在PANC-1细胞中敲除HNRNPC后基因表达的变化。测序结果显示,HNRNPC影响了基因的选择性剪接数量,如TAF8、ACOX1和RNF121,这些基因在癌症发展中起着关键作用(图4A)。通过对选择性剪接显著改变的基因进行GO富集分析,作者发现在敲除HNRNPC后,转录因子IID(TFIID)和RNA聚合酶II组成的起始前复合物相关的基因显著富集(图4B)。
通过在NCBI网站(https://www.ncbi.nlm.nih.gov/)中搜索转录本信息,作者发现由于TAF8S和TAF8L使用不同的终止密码子,因此TAF8S和TAF8L都可以被翻译(图4D)。剪接亚型TAF8L(包含第8外显子)的表达水平上调,而剪接亚型TAF8S(不包含第8外显子)的表达水平下调(图4C)。通过qRT-PCR(图4E和F)在PANC-1和CFPAC-1细胞中证实了这些结果。这表明TAF8的选择性剪切可被HNRNPC调控。
为了确定这两种亚型是否参与了HNRNPC介导的PDAC转移,作者首先在PANC-1和CFPAC-1细胞中敲除TAF8,然后分别表达TAF8S或TAF8L。Transwell检测显示,TAF8S促进了PDAC细胞的侵袭性,而TAF8L抑制了PDAC细胞的侵袭性(图4g和4H)。这些结果表明,HNRNPC影响了TAF8的选择性剪接,而TAF8L抑制PDAC细胞的侵袭性。
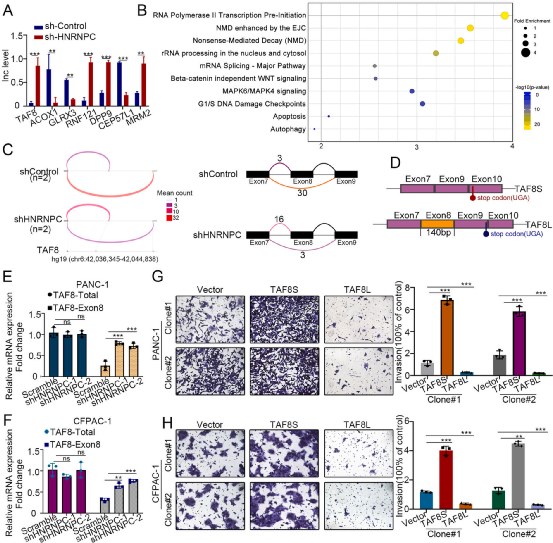
图4
Figure 5 HNRNPC以m6 A修饰依赖的方式调控TAF8的选择性剪接
为了确定HNRNPC介导的TAF8选择性剪接的潜在机制,进一步研究HNRNPC是否与TAF8相互作用。作者通过使用网站预测TAF8的m6A结合位点(http://rmvar.renlab.org/)和RNA结合位点(http://rbpdb.ccbr.utoronto.ca/),发现在TAF8 pre-mRNA的第8外显子附近有5个潜在的m6A结合位点(图5A)和2个潜在的HNRNPC结合位点(图5B)。甲基化RNA免疫共沉淀(Me-RIP)检测显示,m6 A抗体与TAF8的结合强度高于IgG对照(P < 0.001,图 5A)。RNA免疫共沉淀(RIP)检测显示,HNRNPC与TAF8的结合明显高于IgG对照(P < 0.001,图5B)。
为了明确m6 A修饰是否增强了HNRNPC与TAF8的结合,作者对TAF8的m6 A结合位点进行突变,以及外源性TAF8-m6A突变实验(图5C)。在TAF8的m6A结合位点发生突变后,HNRNPC与TAF8之间的相互作用显著减弱(图5D)。在内源性突变TAF8的m6 A位点后,TAF8S亚型在PDAC细胞中的表达下降(图5E)。这些结果表明,TAF8的m6A位点突变可能会影响HNRNPC与TAF8转录本相互作用,导致TAF8L表达增加。
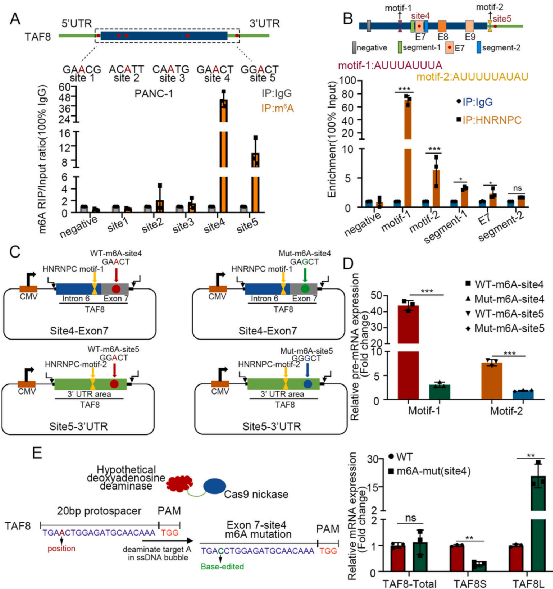
图5
Fig 6 TAF8L通过调节侵袭相关基因的表达来逆转HNRNPC在PDAC中的功能
为了确定HNRNPC通过TAF8发挥作用,作者首先在PANC-1和CFPAC-1细胞中过表达HNRNPC然后过表达TAF8L(HNRNPC+/TAF8L+)。Transwell检测结果显示,与对照组相比,HNRNPC+/TAF8L +细胞的侵袭性明显降低(图6A和6B)。相比之下,在PANC-1和CFPAC-1细胞中敲除HNRNPC并敲除TAF8L(shHNRNPC+siTAF8L)。Transwell检测显示,与对照组相比,shHNRNPC + siTAF8L细胞的侵袭性显著增强(图6C和6D)。
为了进一步探索TAF8发挥其生物学功能的途径,作者对sgTAF8-TAF8L + PDAC细胞进行了RNA测序。GSEA分析显示,侵袭性相关通路的表达发生了显著变化,如ERK通路(图6E和6F)。免疫印迹分析显示,敲除TAF8L可以逆转与肿瘤侵袭相关的HNRNPC靶基因的表达(图6G)。这些结果表明,TAF8L通过影响侵袭相关基因的表达来逆转HNRNPC在PDAC中的功能。
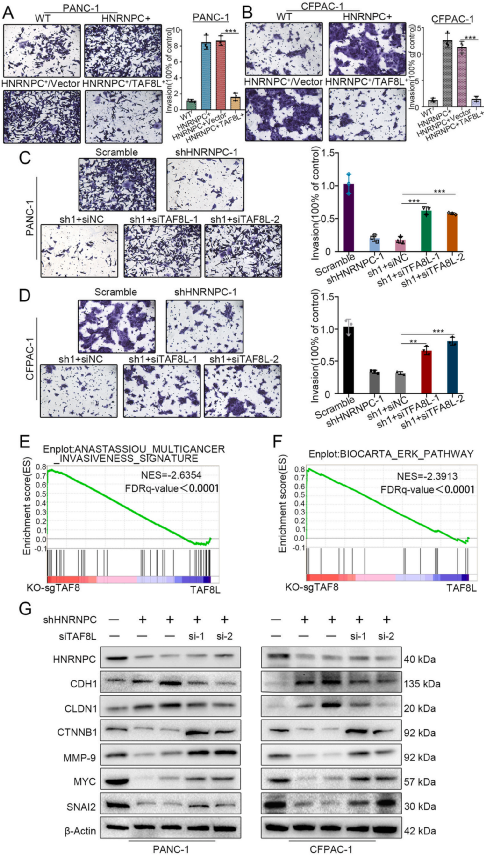
图6
文章主要阐述了HNRNPC在PDAC组织中过表达,其表达水平与PDAC患者的肝转移和总生存期较差相关。机制上,HNRNPC以m6A依赖的方式与TAF8转录本结合,导致TAF8的抗转移选择性剪接(TAF8L亚型)的下调,TAF8L逆转了HNRNPC在促进PDAC侵袭性方面的功能。
综上,今日“m6 A+可变剪切”解析就到此为止啦。
悄悄的说一句,我们的国自热点可变剪切文献已经分享两篇啦,最后一篇高分文献我们下周分享给大家,想提前看的话可以直接添加小编微信:1857002002,提前学提前看哦!

