

蛋白质翻译后修饰
 2024-11-12 09:33:13
2024-11-12 09:33:13
来源/作者:普拉特泽-生物医学整体课题外包平台
人类约有2.5W个基因、小鼠约有3W个基因、水稻约有5-6W个基因、拟南芥约有2.5W个基因、果蝇约有1-1.5W个基因、酵母约有6500个基因。
问题来了?有这么多基因,就会有这么多蛋白质吗?
如果按一个基因对应一个蛋白质来算,人类的2.5万个基因能翻译合成2.5万种蛋白质,解析人类全部蛋白质似乎指日可待。但,事与愿违,这2.5万种基因编码的蛋白质个个都是“千变万化”的孙悟空,而且每个孙悟空,都具有超过400种不同的变化形态,不同的变化形态还可能同时进行。因此,解析全部的蛋白质结构和功能,就变得非常非常的困难,这令科学家们点灯熬油、抓耳挠腮、还百思不得其解。。。
为什么会产生这种现象呢?听过我们之前,关于转录本那期的小伙伴可能知道,单个基因在转录后,可以通过可变剪接、或RNA编辑等,产生多个不同的转录本,不同的转录本可以形成不同的蛋白质亚型,这,是蛋白质多样性的第一个原因。
而导致蛋白质千变万化的第二个原因,则是蛋白质翻译后修饰的存在。
顾名思义,蛋白质的翻译后修饰就是指,在已经翻译出来的蛋白质上,添加上各种千奇百怪的功能基团的过程。据报道,人体内发生的蛋白质翻译后修饰种类,超过了400种,常见的,有磷酸化修饰、甲基化修饰、乙酰化修饰、泛素化修饰、糖基化修饰、苏木化修饰、乳酸化修饰等等。。。。这些可以单独、或多个,同时发生于某个特定时空里的蛋白质上,也可以发生在蛋白质生命周期的任何阶段。简单来说,我们,可以把刚刚翻译出来的蛋白质看成是一个刚出生的小baby,把各种修饰看成是baby的衣服或装饰品,在他今后的各个人生阶段,他都可能会穿上不同的衣服,佩戴不同的装饰品,直到生命的终点。搞不好,他还可能是一位穿搭博主或Coser,令认识他的人每次碰到他都很难认得出来。除了修饰的多样性外,蛋白质的翻译后修饰也是可逆的,就像这个baby穿上了某件衣服后,也可以脱下这件衣服一样。
如果说,转录水平和mRNA 水平的变化增加了转录组相对于基因组的大小,那么无数种不同的蛋白质翻译后修饰类型,则使得蛋白质组的大小相较于基因组和转录组呈现指数型的增加。目前,人体内的蛋白质总数已超过一亿种。科学家们的目光也从基因组水平过渡到了更加复杂多变的蛋白质组,这,是一个必然的研究趋势。

图一、多种蛋白质形成的原因
我们来看看,如果DNA、RNA、蛋白质这三种生物大分子是一对一的关系,那么
2.5万个基因,2.5万个转录本,2.5万种蛋白质,Over。
但现实是,2.5万个基因,10万种转录本,一亿多种蛋白质。
二、蛋白质翻译后修饰有哪些类型?
本期视频我们将带大家了解研究最为广泛的第三类蛋白质翻译后修饰,也就是氨基酸残基的共价修饰。其余两类修饰:一级结构修饰,以及辅基及金属离子的结合修饰,受制于篇幅原因,本期视频不做特别讲解。
那什么是蛋白质氨基酸残基的共价修饰呢?两个重点,一,是发生在蛋白质氨基酸残基的侧链上,而非蛋白质主链上。二,是共价修饰。共价修饰是指蛋白肽链上的一些基团与化学基团或小蛋白质发生可逆的共价结合,从而改变蛋白的性质和功能。常见的共价修饰方式包括磷酸化、泛素化、甲基化、乙酰化、糖基化、乳酸化等等,由专门的酶类催化。接下来我们就将目前常见的几类修饰类型一一进行讲解。
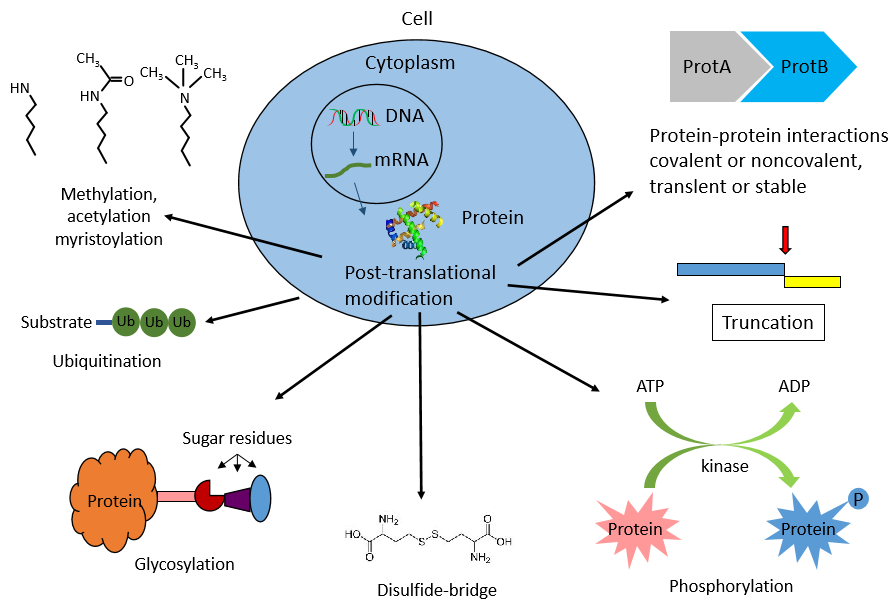
图二、蛋白质翻译后修饰类型
1. 磷酸化:
首先,我们来看一下蛋白质的磷酸化。在学习磷酸化这一修饰过程之前,我们先来了解一些背景知识:有研究发现,大多数控制我们身体中重要生理功能过程的蛋白质,如肌肉收缩或神经传导,以两种状态存在:静息与活跃。在细胞的静息状态下,它们是不活动的,而需要发挥作用时,这些蛋白质会通过添加或移除磷酸基团改变构象,从静息形式转换为活性形式,从而发挥生理功能,这一过程就涉及到蛋白质的磷酸化或去磷酸化。
蛋白质磷酸化是指由蛋白质激酶催化的,将ATP(三磷酸腺苷)或GTP(三磷酸鸟苷)上的磷酸基团转移到底物蛋白质氨基酸残基(主要是丝氨酸、苏氨酸、酪氨酸)上的过程。该过程的逆过程则称为去磷酸化。添加磷酸基团的酶叫做蛋白激酶,移除磷酸基团的酶叫做蛋白磷酸酶。初高中时期我们学习的ATP和ADP的相互转化,应该是我们生物学习中最早接触的磷酸化和去磷酸化,也是目前最主要的信号转导方式。
接下来我们一起来看一下磷酸基团是如何加到目标蛋白上去的。
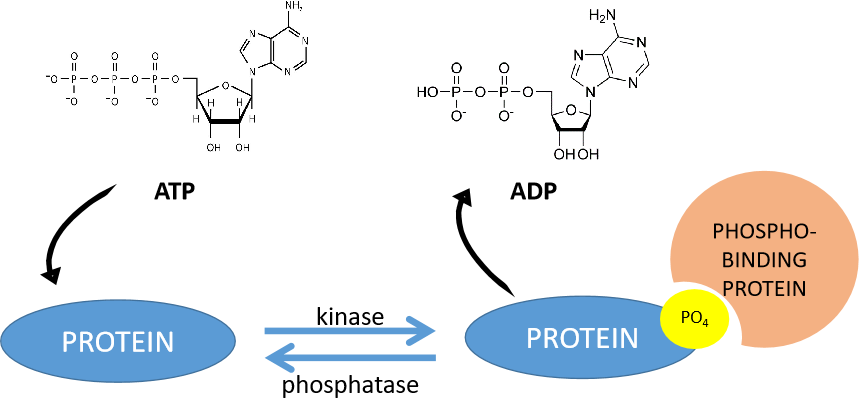
图三、磷酸化作用机制
磷酸化到底有多重要呢?在研究信号通路的活化过程中,为什么大家都选择检测磷酸化修饰的蛋白质?因为蛋白质磷酸化修饰几乎包含在所有的细胞反应中,也几乎涉及所有类型的细胞信号转导途径。这种修饰方式能够迅速且可逆地调节蛋白质的活性、稳定性和相互作用,是细胞对外界刺激作出反应的重要机制。
那么发生磷酸化后的蛋白质会发生什么变化呢?
① 首先,发生磷酸化后,蛋白质的表面电荷或构象会发生改变。这种变化可能使得某些酶类蛋白质的活性位点更加暴露或易于与底物结合,从而增强酶的催化能力,也可能影响到其与其他蛋白质或DNA、RNA等核酸的结合能力。
② 其次,磷酸化修饰可以影响蛋白质在细胞内的定位。例如,某些蛋白在磷酸化后可以暴露或隐藏自己的核定位信号,从而影响其在细胞核和细胞质之间的穿梭。
1. 泛素化:
今天我们要学习的第二个蛋白质翻译后修饰的类型是泛素化,在这之前也需要了解一些背景知识。首先问大家一个问题,什么是泛素?泛素是含76个氨基酸、大小约为8.6 kDa的小蛋白质。人类基因组中有四个基因编码泛素:UBB,UBC,UBA52和RPS27A,泛素蛋白的氨基酸序列为:MQIFVKTLTGKTITLEVEPSDTIENVKAKIQDKEGIPPDQQRLIFAGKQLEDGRTLSDYNIQKESTLHLVLRLRGG。泛素具有7个赖氨酸残基(K6,K11,K27,K29,K33,K48,K63)和一个甲硫氨酸残基(M1)。泛素之间主要通过赖氨酸残基和甲硫氨酸残基进行连接,由此产生的泛素链具有一定的拓扑结构,可通过对蛋白底物进行修饰并决定底物的功能。
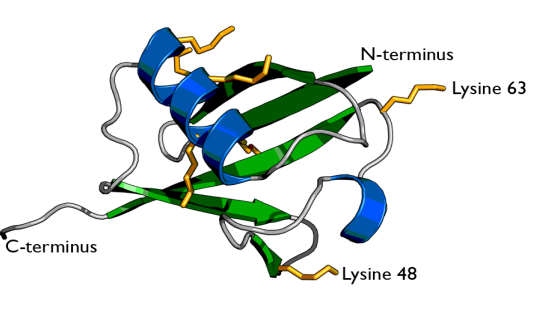
图四、泛素分子的结构
将泛素添加到底物蛋白质中的过程称为蛋白质的泛素化(具体表现为泛素的甘氨酸的C末端附加在目标蛋白的赖氨酸上),这种现象在真核生物中普遍存在且高度保守。蛋白质泛素化是一种动态的翻译后修饰,几乎涉及真核生物生命活动的所有方面。
泛素化的过程主要涉及三种酶类,分别是泛素激活酶E1、泛素结合酶E2、泛素连接酶E3。人源的E1酶类有2种:UBA1和UBA6;人源的E2酶类有35种;人源E3酶类有数百种。其中E3泛素化连接酶决定靶蛋白的特异性识别。泛素化的过程具体可分为以下三个步骤:活化、结合、连接(动画演示)
简而言之,也就是在E1、E2、E3三类酶的依次催化下,泛素以特异性的方式连接到靶标蛋白上或泛素链上。泛素化的逆过程为去泛素化,该过程由去泛素化酶(DUB)执行,去泛素化酶可以通过水解泛素分子之间或泛素与底物蛋白之间的肽键或异肽键,来逆转泛素化修饰。该酶从底物中除去泛素并将泛素再循环到胞质池中。
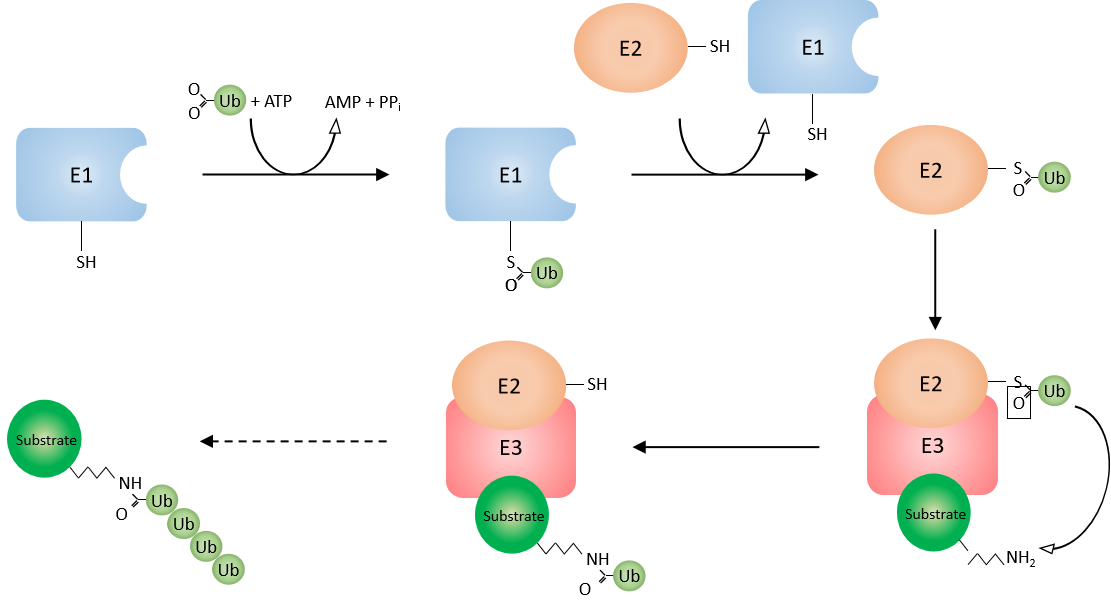
图五、泛素化作用机制
被泛素化修饰后的蛋白质功能发生了哪些变化呢?
① 泛素化最为人熟知的作用是标记蛋白质进而蛋白质降解。泛素化过程中形成的泛素化链被26S蛋白酶体识别并介导蛋白质的降解,从而调节蛋白质的数量和细胞内的蛋白质状态。此外,有些膜蛋白质或者酶被泛素化之后会进入溶酶体进而被降解。但是如果是单个泛素分子附着在靶蛋白上,这种修饰类型通常不会导致蛋白质的降解,而是通过改变蛋白质的空间构象进而影响蛋白质的活性。
② 泛素化可以修复DNA并调控转录。某些修复因子通过泛素化被招募到DNA损伤位点,从而参与DNA修复过程。此外,转录因子的泛素化可以影响其稳定性和转录活性,从而调控基因表达。
③ 泛素化可以影响蛋白质的定位。例如,它可以将蛋白质从细胞核转移到细胞质,或者将膜蛋白送入内吞途径。
④ 泛素化还调节受体蛋白的内吞和降解。泛素化修饰后的受体被内吞小体识别并包裹,形成内吞囊泡,进而与溶酶体融合,完成受体的降解。
⑤ 泛素化可以调控细胞自噬的过程。在自噬过程中,泛素化标记了需要被自噬体包围并降解的损坏的细胞器或蛋白质聚集体。这是细胞清理内部大分子结构的一种机制。
1. 苏木化:
苏木(SUMO)是小泛素相关修饰物(small ubiquitin-related modifier)的缩写,苏木蛋白的大小约为10kDa,含有100个氨基酸残基。苏木蛋白与泛素的序列相似性仅18%,但二者在高级结构上高度相似,核心都是保守的Ub折叠(Ub-fold)结构域。苏木蛋白与泛素蛋白有一个比较明显的区别,那就是苏木蛋白有一个长而灵活的N端延伸结构。
在人类基因组中,目前主要有4种亚型的SUMO蛋白,分别是SUMO1、SUMO2、SUMO3和SUMO4。这些亚型具有一定的序列差异,但总体上都保持了相似的结构和功能。在氨基酸水平上,SUMO2与SUMO3具有97%的同源性(通常简称为SUMO2/3),而其与SUMO1只有46%的同源性。目前SUMO1、SUMO2、SUMO3的功能已陆续被解析,SUMO4主要在肾脏、脾脏组织和淋巴结等免疫组织中表达,其功能尚不明确,但有研究发现SUMO4与1型糖尿病的易感性具有相关性。
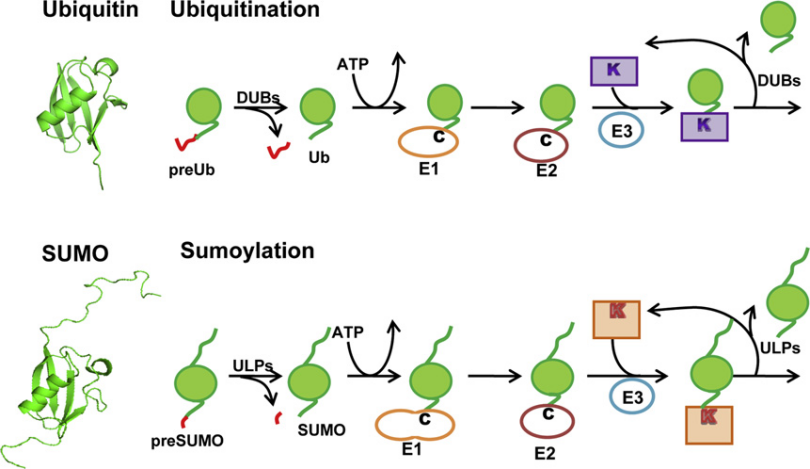
图六、苏木蛋白与泛素蛋白的结构比较
蛋白质苏木化(SUMOylation),是指小分子泛素相关修饰蛋白SUMO共价结合到目的蛋白质的赖氨酸残基上,导致目的蛋白分子被修饰的过程。1996年,类泛素蛋白修饰分子SUMO及SUMO化修饰首次被研究报道,近20年来,从酵母到人等各种真核细胞都发现其修饰的底物蛋白,SUMO化修饰已经被视为一种很普遍的蛋白翻译后修饰方式。SUMO化修饰同样是一个可逆的过程。去苏木化蛋白(如SENPs)可以去除与目标蛋白质结合的SUMO分子,从而恢复目标蛋白质的原始状态。这种可逆性使得SUMO化修饰在细胞信号传导和基因表达调控中具有重要的调节作用。
蛋白质苏木化主要包括以下步骤:SUMO前体的成熟、活化、结合、连接等
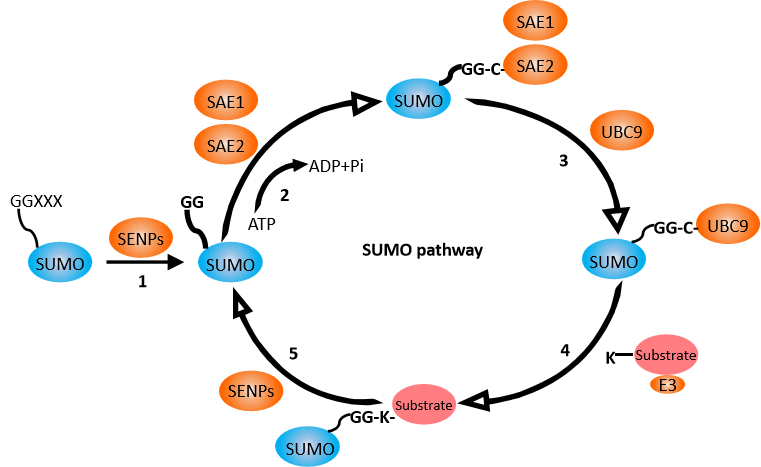
图七、苏木化作用机制
蛋白质经历苏木化修饰后其功能会发生哪些变化呢?
① 首先SUMO化可以保护蛋白质免受泛素化和蛋白质降解。例如,PML蛋白的SUMO化可以防止其被降解,从而增强其稳定性。
② 改变蛋白质的细胞内分布:SUMO化可以调控蛋白质在细胞核和细胞质之间的转运。例如,某些转录因子在SUMO化后会转运到细胞核内,从而调控基因表达。
③ 调控转录因子的活性:SUMO化可以抑制或激活转录因子的活性。例如,p53蛋白的SUMO化可以抑制其转录活性,从而调控细胞周期和凋亡。
④ 调节蛋白质-蛋白质相互作用:SUMO化可以改变蛋白质的构象或表面特性,从而影响其与其他蛋白质的结合。例如,SUMO化的RanGAP1在核孔复合体中的定位依赖于其与RanBP2的相互作用。
⑤ 参与DNA修复:SUMO化可以调节参与DNA修复的蛋白质的功能。例如,RAD51蛋白的SUMO化对同源重组修复过程至关重要。
⑥ 调控细胞周期(影响细胞周期的进程:SUMO化通过调控细胞周期相关蛋白的活性和稳定性,调节细胞周期的各个阶段。例如,细胞周期蛋白CDK1的SUMO化在细胞分裂过程中起重要作用。
⑦ 调控凋亡:SUMO化可以调节凋亡相关蛋白的活性,从而影响细胞存活和凋亡。例如,Fas相关死亡域蛋白(FADD)的SUMO化可以抑制细胞凋亡。
2. 乙酰化
乙酰化是在乙酰基转移酶的作用下,将乙酰的乙酰基COA连接到蛋白质赖氨酸残基上上的过程。在去乙酰化酶的催化下使乙酰化蛋白脱去乙酰基的过程则为去乙酰化。蛋白质乙酰化主要分为两类:蛋白N端的乙酰化修饰和蛋白赖氨酸上的乙酰化修饰。
① N端乙酰化修饰:主要由N乙酰转移酶(NATs)催化,多发生在真核生物的新生蛋白上。
② 赖氨酸乙酰化修饰:是一个可逆的过程,主要由赖氨酸乙酰化酶(KATs)催化乙酰化,赖氨酸去乙酰化酶(KDACs)催化去乙酰化。
乙酰化修饰在真核和原核生物中都普遍存在,且对蛋白质构象、活性以及稳定性等调控具有重要的调控作用。最早的乙酰化研究主要集中在组蛋白上,随着研究的深入,也有越来越多的非组蛋白乙酰化被发现。
赖氨酸乙酰化修饰主要包括以下步骤:(动画演示)
① 在乙酰基转移酶的催化下,乙酰辅酶A与蛋白质的赖氨酸残基发生反应。
② 乙酰基转移酶提供反应的微环境,使得携带乙酰基的乙酰辅酶A与接受乙酰基的受体蛋白(蛋白质赖氨酸残基)高度贴近。
③ 转乙酰基酶催化赖氨酸残基的氨基去质子化,使其处于亲核状态,进而亲和进攻乙酰辅酶A的羰基碳。
④ 最后,完成蛋白质的乙酰化并释放辅酶A。
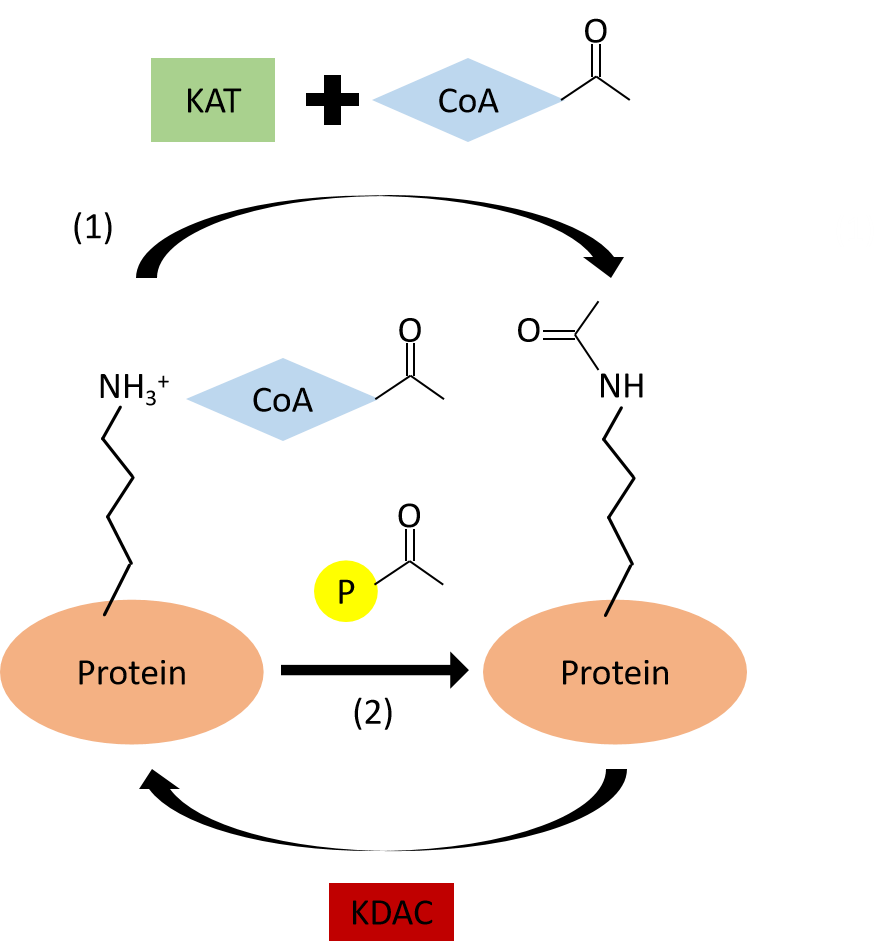
图八、乙酰化作用机制
蛋白质经历乙酰化修饰后其功能会发生哪些变化呢?
① 影响染色质结构和基因表达:组蛋白乙酰化是调控基因表达的重要机制之一。组蛋白上的赖氨酸残基被乙酰化后,染色质结构变得更加松散,使得转录因子和RNA聚合酶更容易接触DNA,从而促进基因表达。反之,去乙酰化会使染色质变得更加紧密,抑制基因表达。
② 调控蛋白质的稳定性:乙酰化修饰可以保护蛋白质免受泛素化和随后的蛋白质降解。例如,p53蛋白的乙酰化可以增强其稳定性和功能,抑制其被泛素化和降解。
③ 调节蛋白质-蛋白质相互作用:乙酰化可以中和赖氨酸残基的正电荷。这种电荷变化可以影响蛋白质与其他带电分子或蛋白质的结合能力。例如,乙酰化的p300/CBP与转录因子结合,调节转录活性。
④ 调控转录因子的活性:乙酰化可以改变转录因子的构象,从而影响其DNA结合能力和转录活性。例如,乙酰化的p53具有更高的转录活性,可以有效启动凋亡相关基因的表达。
⑤ 调控细胞周期进程及凋亡:乙酰化可以调节细胞周期蛋白及凋亡相关蛋白功能,影响细胞周期的各个阶段及细胞的生存和凋亡。
⑥ 参与DNA修复:乙酰化的蛋白在DNA损伤部位的聚集,有助于DNA修复蛋白的招募和修复过程的进行。
⑦ 调节代谢酶的活性:乙酰化后的蛋白代谢酶的功能和活性改变。例如,乙酰化的丙酮酸脱氢酶(PDH)活性降低,影响葡萄糖代谢过程。
⑧ 应对细胞应激条件:乙酰化后的蛋白正通过调控应激反应相关蛋白的活性和稳定性,帮助细胞应对各种应激条件。例如,热休克蛋白Hsp90的乙酰化在应激条件下调控其功能。
3. 糖基化
在学习糖基化之前我们先来了解一下糖和糖蛋白。糖蛋白是由糖类与蛋白质共价结合的分子,糖类的范围从单糖到复杂具有侧链结结构的多糖,种类众多。而糖基化是一种将糖类分子通过共价键连接到蛋白质氨基酸残基上的过程,这个过程通常在内质网和高尔基体中进行,涉及多种糖基转移酶的参与。糖基化过程十分复杂,目前在很多蛋白中(如转录因子、热休克蛋白、核小孔蛋白、RNA聚合酶II、致癌基因翻译产物、酶等)都发现了糖基化这种翻译后修饰方式。
蛋白质糖基化主要有两种类型:O-糖基化和N-糖基化。O-糖基化发生在丝氨酸(Ser)和苏氨酸(Thr)的羟基上,如果这些氨基酸首先被羟基化,也可以发生在赖氨酸(Lys)和脯氨酸(Pro)上。O-糖基化由于没有明确的共识序列或共同核心结构,因此研究较为复杂。
而N-糖基化主要涉及糖链与新生肽链中特定天冬酰胺(Asn)自由的NH2的连接,也是目前主要研究的对象。N-糖基化有一段共识序列:Asn-Xaa-Ser/Thr,其中Xaa代表除脯氨酸(Pro)以外的任何氨基酸。这个序列是N-糖基化发生的基础,即当蛋白质序列中存在这样的天冬酰胺(Asn)残基时,其侧链的氨基就有可能被N-连接的糖链所修饰。N-糖基化
还有一个共同核心结构是一个由2个N-乙酰葡糖胺(GlcNAc)和3个甘露糖(Man)分子组成的五糖结构,通常表示为GlcNAc2Man3。这个核心结构是N-糖链的基础,所有的N-糖链都是在这个核心结构上进一步延伸和修饰而成的。
糖基化包括五个步骤(以N-糖基化为例):寡糖链合成、转移酶识别、糖链转移、加工修饰。(动画演示)
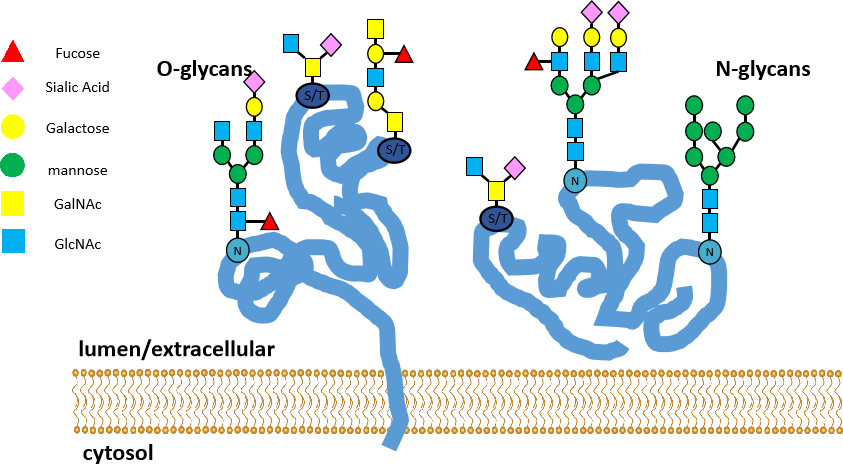
图九、糖基化作用机制
作为一种普遍存在的翻译后修饰,糖基化后的蛋白质功能有哪些改变呢?
① 免疫保护:糖基化可以影响免疫球蛋白(抗体)的结构和功能,进而影响其识别并结合抗原的能力。此外,细胞表面的糖基化蛋白还能作为“自我”与“非我”的识别标志,帮助免疫系统区分外来病原体和自身组织。
② 病毒的复制:病毒在感染细胞时,会利用宿主细胞的糖基化机制来修饰自己的蛋白质和糖蛋白,这些修饰对于病毒颗粒的组装、成熟、释放以及逃避宿主免疫系统的攻击都至关重要。例如,流感病毒的血凝素(HA)蛋白上的糖基化修饰可以影响病毒的感染性和抗原性。
③ 细胞生长:细胞表面的糖基化模式与细胞的增殖、分化和凋亡等过程密切相关。特定的糖基化修饰可以调控生长因子受体的活性和信号转导途径,从而影响细胞的生长速率和命运。
④ 细胞与细胞之间的黏附:细胞表面的糖蛋白和糖脂通过其糖链部分与相邻细胞或细胞外基质中的分子相互作用,介导细胞间的黏附和信号传递。这些相互作用对于组织结构的维持、细胞迁移、伤口愈合等过程至关重要。
⑤ 炎症的产生:在炎症反应中,糖基化修饰也发挥着重要作用。例如,某些炎症介质(如细胞因子和趋化因子)的糖基化修饰可以影响其稳定性和生物活性,从而调控炎症反应的强度和持续时间。
1. 乳酸化
乳酸 ( Lactate ) 是细胞糖酵解途径重要的含碳代谢产物,它的生物学功能因肿瘤细胞中Warburg效应的存在,得到了广泛关注(该理论认为,肿瘤细胞即使在有氧条件下,也倾向于通过糖酵解途径(而非线粒体氧化磷酸化)来产生能量)。乳酸也是细胞无氧呼吸的代谢产物,早期被认为是细胞的代谢废物,但随着研究深入,乳酸被发现具有多种重要的生理病理功能。2019年10月24日,芝加哥大学赵英明教授课题组在Nature上发表研究成果,该研究揭示了乳酸在表观遗传学中的作用,并首次报道乳酸可以修饰组蛋白,从而调控基因的转录。该研究不仅拓展了大家对乳酸的认识,也掀起了乳酸化修饰的研究热潮。由于乳酸化的研究起步较晚,目前对于蛋白质乳酸化的研究还在初步阶段,大家也可以多多关注下这种修饰方式,其研究前景还是非常广泛的。
由于目前乳酸化的修饰作用主要发现在组蛋白上,因此我们也对组蛋白做一个简单的介绍。组蛋白是真核生物体细胞染色质与原核细胞中的碱性蛋白质,与DNA共同组成核小体结构。它们是染色质的主要蛋白质组分,作为DNA缠绕的线轴,在维持染色质结构和稳定性方面发挥关键作用,组蛋白的氨基酸序列在不同物种之间高度保守组蛋白,且能进行多种修饰。组蛋白修饰的调控可以被归类为三类蛋白:Writers(写入者)、Erasers(擦除者)和Readers(读取者)。Writers是负责在组蛋白上添加修饰基团的蛋白,目前已被报道的组蛋白乳酸化Writers蛋白有p300、GCN5、HBO1。Erasers则是负责去除组蛋白上修饰基团的蛋白,恢复组蛋白的原始状态,目前已报道组蛋白乳酸化的Erasers有:HDAC1-3、HDAC8和SIRT1-3。Readers是能够识别和结合特定修饰基团的蛋白,从而调控基因表达和其他细胞过程,目前已被报道的组蛋白乳酸化Readers蛋白为Brg1蛋白。这三类蛋白共同参与组蛋白的动态修饰和功能调节。
蛋白质乳酸化的过程大概分为三步:乳酸与蛋白质的接触、酶促反应、修饰产物的形成(动画演示)
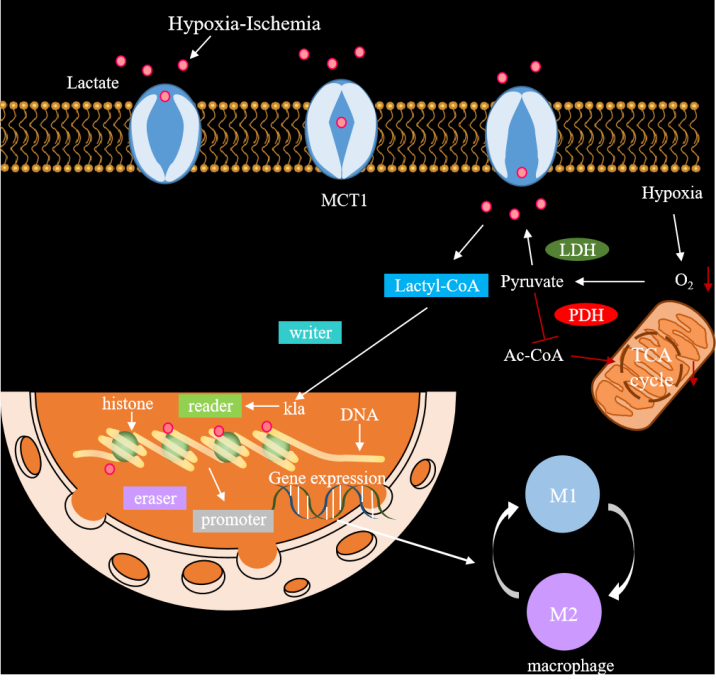
图十、乳酸化作用机制
蛋白质发生乳酸化修饰之后功能会发生哪些变化呢?
① 影响转录因子功能:乳酸化可以修饰组蛋白,从而影响染色质结构和基因表达。例如,组蛋白H3的赖氨酸乳酸化被发现可以促进基因转录,特别是在高代谢活动的细胞中。
② 作为代谢与基因调控的桥梁:乳酸化作为代谢产物乳酸的一种修饰方式,可以连接细胞代谢状态与基因调控,响应代谢变化调节基因表达,从而适应环境变化。
③ 调控炎症基因:研究发现,乳酸化可以调节炎症相关基因的表达,影响免疫细胞的功能。例如,在巨噬细胞中,乳酸化修饰可以激活炎症基因,促进炎症反应。
④ 影响癌症细胞行为:乳酸化在癌症中也具有重要作用。乳酸化修饰可能影响癌细胞的基因表达、代谢重编程和肿瘤微环境,从而促进肿瘤的生长和转移。
⑤ 调控细胞分化和命运:乳酸化修饰可以影响细胞分化和命运决策。例如,乳酸化修饰可以调控干细胞和前体细胞的分化,影响组织发育和再生。
⑥ 信号传导:乳酸化修饰可能影响关键信号分子的功能和相互作用,从而调控细胞信号传导通路。尽管具体机制尚未完全阐明,但这一领域的研究正在不断深入。
⑦ 响应代谢应激:乳酸化修饰可以作为细胞应答代谢应激的一种机制。例如,在低氧条件下,细胞通过增加乳酸化修饰来调节基因表达和代谢途径,以适应缺氧环境。
⑧ 反馈调节代谢通路:乳酸化修饰可以作为代谢通路的反馈调节机制,通过修饰关键代谢酶和调控代谢基因的表达,维持细胞代谢的平衡和稳态。
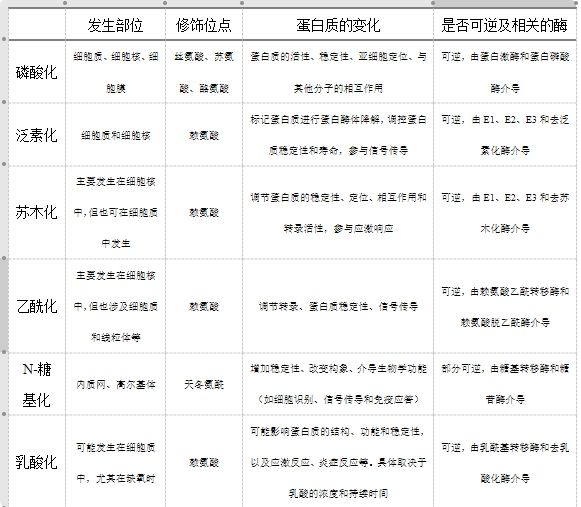
好了,上述我们给大家介绍了几种常见的蛋白质修饰类型,现在咱们一起来总结一下。这里我们给大家绘制了一个表格(其中乳酸化作为一种新发现的蛋白质翻译后修饰,其修饰的具体机制在现有研究中并不明确,因此我们根据相关研究进行了推测,仅供大家参考)。
表一、不同蛋白质翻译后修饰的差异比较
三、蛋白质翻译后修饰该如何来研究?
当前,大家对于蛋白质翻译后修饰的探索和认识,很大程度上得益于质谱技术的发展。因为,传统的检测方法如Western或免疫沉淀等都依赖于特异性抗体,而抗体很难精确区分蛋白质上结合的小分子的差异,也很难对蛋白质上发生修饰的氨基酸位置进行精确定位。况且,除了模式动物以外,大部分物种表达的蛋白都缺乏有效的抗体,而翻译后修饰分析的抗体更无从谈起。此外,每一种蛋白的每一种修饰的每一个修饰位点,都需要对应的一种抗体来进行分析,其适用的范围非常有限,分析成本太高,也难以应用于系统性层面上的研究。
相比而言,质谱不仅能够对特定蛋白的特定修饰进行精确测定,还能够实现大规模组学水平上的研究与发掘。因为发生翻译后修饰的蛋白与未发生翻译后修饰的蛋白,以及不同的修饰类型之间,最大的差异就在于氨基酸侧链上化学基团的变化,这直接导致蛋白质或肽段在分子量上的差异,而分子量的分析是质谱的拿手好戏。因此在蛋白质翻译后修饰方面,质谱已成为主流的研究技术。
根据蛋白质翻译后修饰的定义我们可知,相较于没有发生翻译后修饰的蛋白,翻译后修饰蛋白会在特定肽段序列有分子量的增加。同时,由于不同的翻译后修饰对肽段质量的改变不同,通过比较实验测得的肽段质量与理论质量之间的差异,我们可以判断修饰的类型。下图展示了利用质谱来鉴定蛋白质的翻译后修饰的原理:在蛋白翻译后修饰方式的质谱分析过程中,蛋白会首先被酶切成肽段,然后进入质谱进行分析;通过质谱分析,得到一系列肽段的相对分子质量信息,对于某一个特定的肽段而言,在没有发生任何翻译后修饰的情况下,它的序列信息和分子量是确定的。但当它发生了某种翻译后修饰之后,例如磷酸化修饰,因为磷酸根的分子量也是确定的,所以在质谱检测过程中,如果发现部分肽段的分子量刚好增加了一个磷酸根的分子量,则可以假设这个肽段发生了磷酸化修饰。再通过二级或多级质谱的图谱进行二次确认,即可实现翻译后修饰类型鉴定及修饰位点分析等。
图十一、质谱技术检测蛋白质翻译后修饰原理示意图
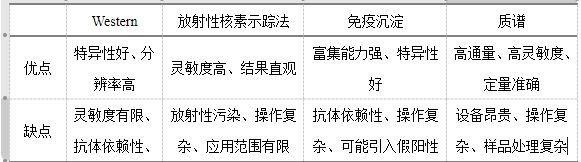
除质谱外还有一些其他的方法可以检测蛋白质的翻译后修饰,如Western Blot、放射性核素示踪法、免疫沉淀(IP)等,下表展示了各类实验方法检测蛋白质翻译后修饰的优缺点。
表二、检测蛋白质翻译后修饰的各类实验方法的优缺点
小伙伴们可以根据实际情况进行选择,如果有合适的抗体的话可以考虑WB或者免疫共沉淀,不差钱的实验室可以用质谱来检测。
好了,以上就是本期的内容啦。目前,研究相对成熟的蛋白质翻译后修饰还仅仅局限于磷酸化、糖基化、乙酰化等10余种修饰,因此蛋白质翻译后修饰有着广泛的研究前景,完全揭秘人体内蛋白质的“千变万化”还需要大家不懈努力,关于视频版本大家直接点击《【蛋白质翻译后修饰】不同类型、机制、功能动画详解,含经验总结;一个视频帮你梳理清楚》就可以观看啦~
