

详细描述巨噬细胞原代培养中细胞分离与培养的具体步骤
 2024-10-24 11:02:17
2024-10-24 11:02:17
来源/作者:普拉特泽-生物医学整体课题外包平台
巨噬细胞原代培养中细胞分离与培养的具体步骤由普拉特泽生物为大家总结分享,普拉特泽生物细胞实验平台专业承接细胞诱导/分化外包、细胞焦亡等细胞实验代做服务,积累专业丰富的实验操作经验。
在巨噬细胞原代培养中,细胞分离与培养的具体步骤可以细分为以下几个关键环节。以下是根据权威来源整理的详细步骤:
一、实验准备
1. 实验动物与试剂
①选择合适的实验动物,如SPF级小鼠,体质量通常在18~22g,雄性,6~8周龄。
②准备必要的试剂,包括细胞培养基(如RPMI 1640)、胎牛血清(FBS)、双抗(抗生素和抗真菌剂)、红细胞裂解液、PBS(磷酸盐缓冲液)、以及用于诱导巨噬细胞分化的细胞因子,如M-CSF(巨噬细胞集落刺激因子)。
2. 实验器械
一次性注射器、手术器械(如眼科剪、眼科镊)、离心管、细胞培养皿、移液枪及枪头等,并确保所有金属器械经过高压灭菌,离心管辐照消毒。

二、细胞分离
腹腔巨噬细胞分离
1. 腹腔注射刺激物
在实验前三天,每天给小鼠腹腔注射1mL的3%巯基乙酸盐肉汤,以刺激巨噬细胞增殖。
2. 处死小鼠并收集腹腔液
⑴采用脱颈法处死小鼠,将小鼠浸泡在75%乙醇中灭菌3-5分钟,然后移至超净工作台。
⑵用预冷的PBS或细胞培养基冲洗腹腔,轻轻按摩小鼠腹部数次,使液体在腹腔内充分流动。
⑶抽取腹腔液,收集至离心管中,并重复冲洗腹腔以增加细胞收集量。
3. 细胞分离与纯化
⑴将收集的腹腔灌洗液在常温条件下以1000rpm/min离心10分钟,弃去上清。
⑵用细胞培养基重悬细胞沉淀,并进行细胞计数。
⑶将细胞悬液接种至细胞培养皿中,置于37℃培养箱中孵育2~3小时,使巨噬细胞贴壁。
⑷弃去未贴壁的细胞,余下的贴壁细胞即为腹腔巨噬细胞。



骨髓巨噬细胞分离
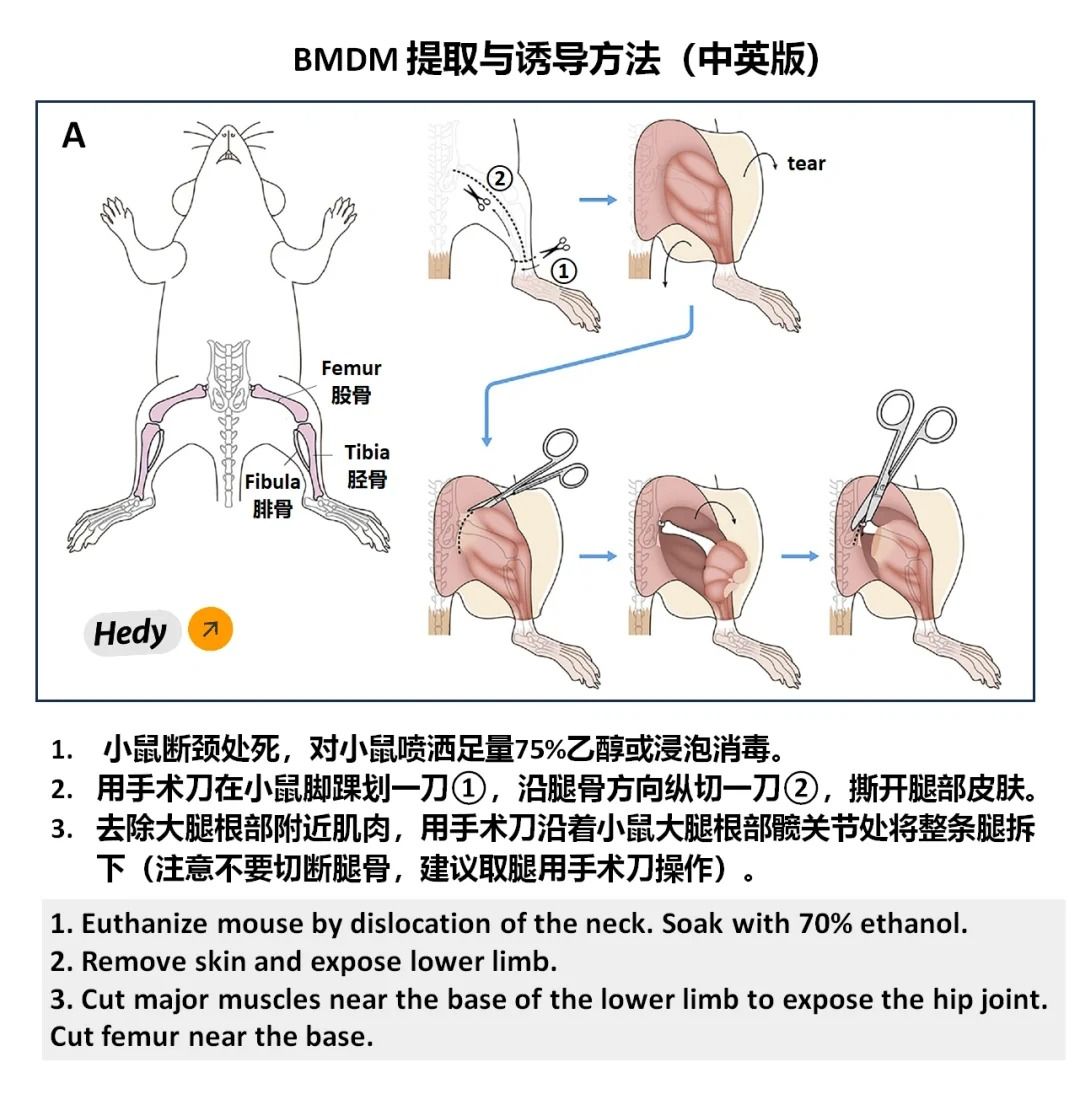
1. 提取骨髓细胞
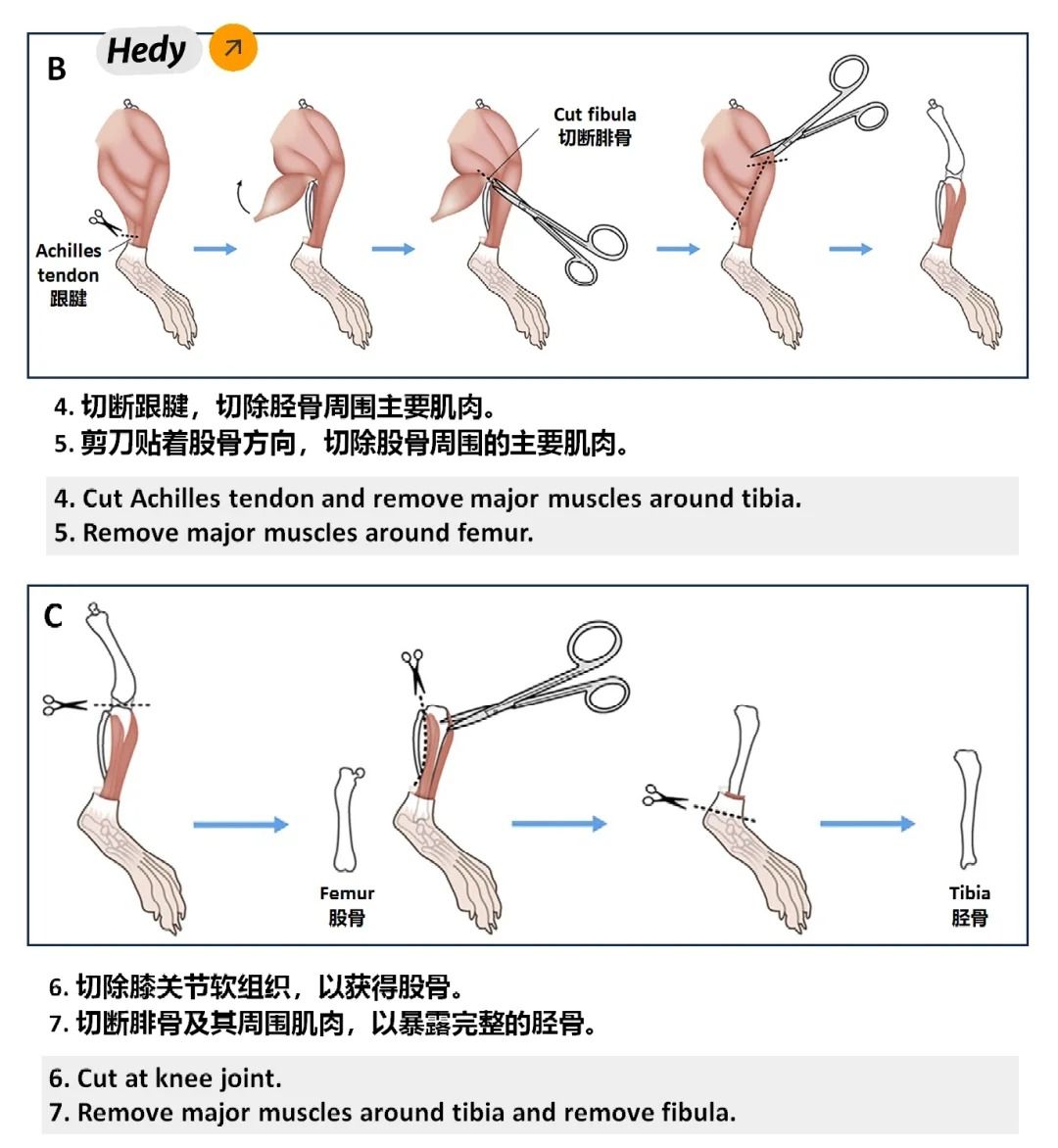
①处死小鼠后,用剪刀和镊子取出其双侧股骨和胫骨,剔除附着的肌肉和组织。
②将骨骼浸泡在75%乙醇中灭菌后,用冷的PBS清洗。
③使用注射器吸取含有M-CSF的诱导培养基,反复冲洗骨髓腔,收集骨髓细胞悬液。
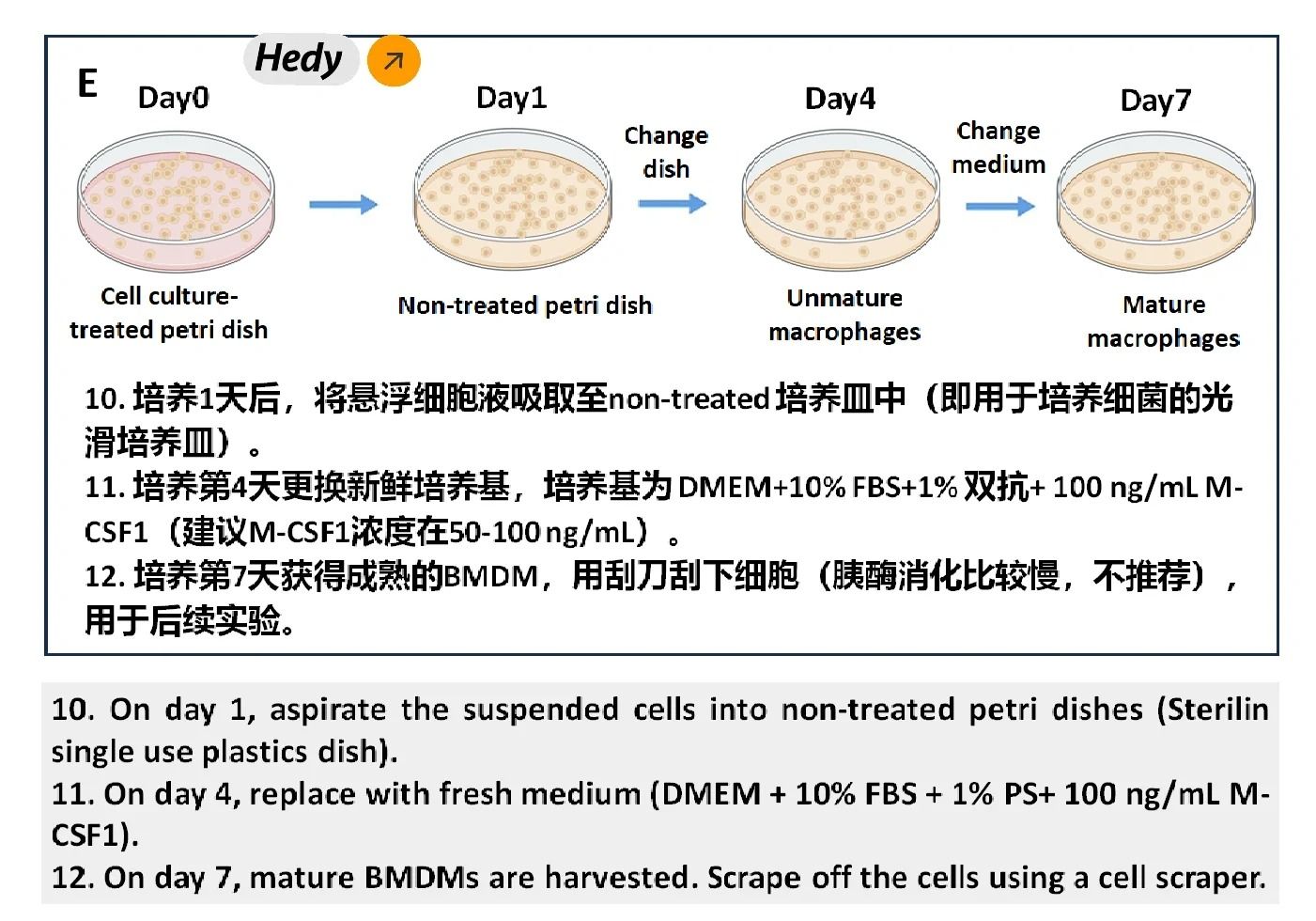
2. 细胞培养与诱导分化
①将骨髓细胞悬液过筛后离心,去除红细胞和杂质。
②用含有M-CSF的诱导培养基重悬细胞,并接种至细胞培养皿中。
③在37℃培养箱中培养,每隔2-3天更换新鲜培养基。
④培养7天后,收集贴壁的骨髓巨噬细胞用于后续实验。
三、细胞培养
1. 细胞贴壁与换液
巨噬细胞贴壁后,需定期更换新鲜的培养基以维持细胞生长环境。
每隔2-3天更换一次培养基,并在更换前用PBS清洗细胞以去除死细胞和杂质。
2. 细胞形态观察
使用倒置显微镜定期观察细胞形态和生长状态。
巨噬细胞通常呈规则圆形或不规则形状,贴壁较快且具有较强的吞噬能力。
3. 细胞计数与活性检测
⑴使用细胞计数板对细胞进行计数,并计算细胞活性。
⑵细胞活性检测通常使用台盼蓝染色法,通过计算活细胞与总细胞的比例来评估细胞活性。
通过以上步骤,可以成功分离并培养出高质量的巨噬细胞原代细胞,为后续的实验研究提供可靠的细胞来源。
欲获得更多的信息和帮助,可通过以下方式联系:
流式检测|病理检测|动物模型|实验服务|分子操作|免疫相关检测
免费热线:18570028002

