长沙可谓是秒入夏,3月份还穿羽绒服呢,转眼才4月下旬街上就到处都是穿短袖的帅哥美女了,不过看天气预报周末还会有一波降温,大家还是留几件厚衣服不要太快把厚衣服压箱底哦。言归正传,本月我们为大家带来的是炎性小体相关的文献。
本次分享的文献题目是:TREM-1 governs NLRP3 inflammasome activation of macrophages by firing up glycolysis in acute lung injury,影响因子10.75分,发表在International journal of biological sciences杂志上,发表时间为2022年1月。
让我们一起来解析作者的实验结果吧~
一、TREM-1的药物阻断减弱LPS诱导的小鼠肺损伤和糖酵解
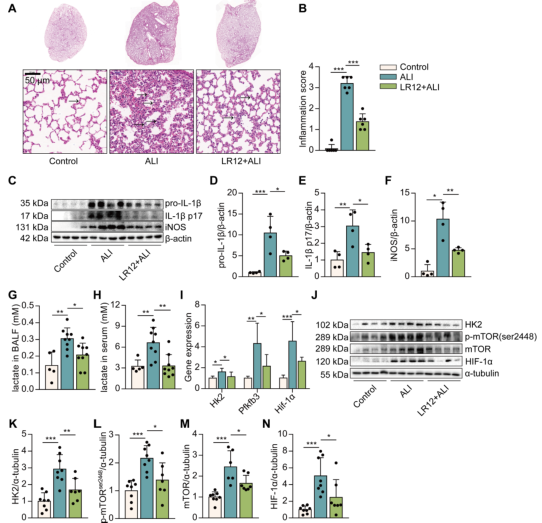
据报道,阻断TREM-1可部分抑制LPS诱导急性肺损伤(ALI)的NLRP3炎症小体激活;另外,糖酵解被认为是巨噬细胞NLRP3炎性小体激活的关键调控。因此,作者想知道阻断TREM-1葡萄糖代谢是否会改变ALI。将小鼠暴露于LR12(TREM-1抑制剂)。结果显示,LR12处理的小鼠的肺中比LPS处理的肺中白细胞浸润、肺泡充血和肺泡屏障厚度均减少(图1A-B)。LR12处理小鼠肺中IL-1β、IL-1β p17和一氧化氮合酶(iNOS)水平显著降低(图1C-F)。同时,经LR12处理的小鼠BALF和血清中乳酸(有氧糖酵解的最终产物)水平也有类似的降低(图1G-H)。LR12处理显著降低了糖酵解途径中编码酶的基因的表达,包括Hk2、果糖-2,6-双磷酸酶3 (Pfkfb3)和Hif-1(图1I)。HK2催化葡萄糖代谢的第一步。经LR12处理的小鼠肺部HK2水平降低(图1J-K)。mTOR激活足以刺激糖酵解。LR12处理显著降低了LPS诱导的磷酸化(p)-s2448-mTOR和mTOR水平(图1J, L, M)。LR12处理小鼠肺部HIF-1α水平显著降低(图1J, N)。以上数据说明了TREM-1抑制减弱肺内炎症和糖酵解。
为了系统地描述TREM-1激活的巨噬细胞的代谢变化,作者检测了乳酸产量、葡萄糖消耗和碳水化合物代谢酶。Mab1187已被证明可以激活TREM-1。结果显示,TREM-1的激活增加了乳酸的产生和葡萄糖的消耗(图2A-B)。GLUT1在巨噬细胞摄取葡萄糖中起重要作用。TREM-1的激活上调了巨噬细胞Glut1基因的表达(图2C)。此外,TREM-1的激活伴随着关键糖酵解酶的表达增加,包括Hk2、Pfkfb3、Pkm2、乳酸脱氢酶A (Ldha)和巨噬细胞中糖酵解关键转录因子HIF-1α(图2C)。在TREM-1激活的巨噬细胞中,HK2和LDHA的蛋白表达也增加(图2D-F)。此外,TREM-1的激活伴随着线粒体复合物III、IV和V蛋白水平的降低(图2G-J),LR12干预可部分恢复LPS诱导的巨噬细胞代谢改变。结果显示,LPS介导的乳酸生成、葡萄糖消耗和糖酵解基因(如Glut-1、Ldha和Hif-1α mRNA表达)的增加被LR12减弱(图2K-M)。以上数据说明TREM-1可促进巨噬细胞的糖酵解但抑制氧化磷酸化(OXPHOS)。

NLRP3炎性小体的激活需要两个步骤:启动和激活。NLRP3复合体的形成是启动NLRP3炎症小体的关键步骤。作者发现TREM-1激动对NLRP3炎性小体的驱动作用。利用Mab1187激活TREM-1可以增加巨噬细胞中的Nlrp3、Pro‐caspase‐1、rrp3和Pro-il-1β的mRNA水平(图3A-C)。而LR12取得相反的效果(补充结果)。此外,Mab1187还能显著增加NLRP3、pro-caspase-1和pro-IL-1β的蛋白表达(图3D-G)。这些结果说明TREM-1的激活促进NLRP3炎性小体启动。TREM-1的激活显著诱导caspase-1 p10和IL-1β p17的分泌(图3H-J)。此外,TREM-1激活巨噬细胞上清液中IL-1β表达上调(图3K)。以上数据表明,TREM-1对NLRP3炎性小体具有直接激活作用。
四、糖酵解的阻断可逆转TREM-1介导巨噬细胞NLRP3炎性小体激活
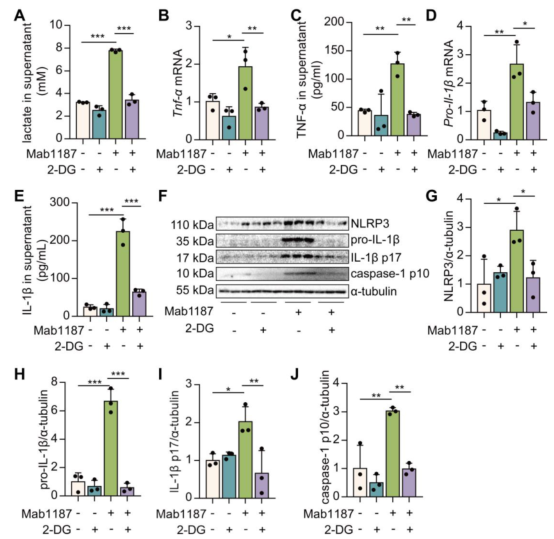
为了评估糖酵解在TREM-1介导的NLRP3炎性小体激活中的作用,糖酵解抑制剂2‐脱氧葡萄糖(2-DG)用于干预巨噬细胞。结果显示,2-DG抑制了TREM-1激活引起的乳酸生成(图4A)。在TREM-1激活的巨噬细胞中,2-DG给药后TNF-α的生成显著降低(图4B-C)。2-DG降低了TREM-1激动剂处理的巨噬细胞NLRP3的表达(图4F-G)。2-DG抑制了TREM-1激活的巨噬细胞中Il-1β基因表达和pro-Il-1β合成(图4D、F、H)。2-DG还减少了由TREM-1激活诱导的IL‐1β分泌(图4E)。2-DG处理可降低TREM-1活化诱导的caspase-1 p10和IL-1β p17蛋白水平(图4F、I和J)。2-DG抑制糖酵解可降低LPS诱导ALI肺中和LPS诱导巨噬细胞中的TREM-1表达(补充结果)。以上结果表明糖酵解对TREM-1诱导NLRP3炎症小体激活是必要的。
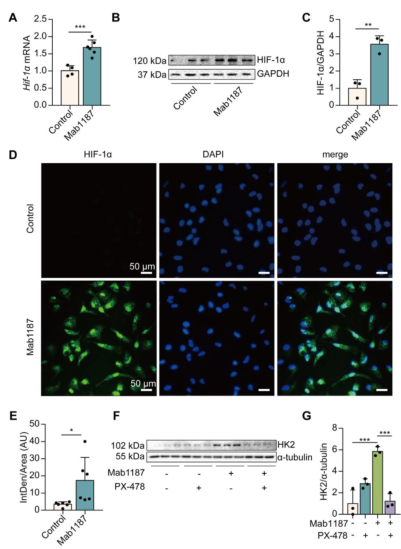
五、巨噬细胞中TREM-1激活可诱导HIF-1α功能性表达
文献报道,HIF-1α通过诱导糖酵解酶(如Glut-1、HK2、PKM2和LDH)的表达介导代谢重编程向糖酵解表型转变。作者发现,即使在常氧条件下,TREM-1激活的巨噬细胞表达明显更高水平的HIF-1α mRNA和蛋白。此外,通过免疫荧光,TREM-1激活促使HIF-1α的积累和向细胞核的转运(图5D-E),此现象可被PX-478(HIF-1α抑制剂)阻断(补充结果)。PX-478处理抑制了TREM-1激活诱导的HIF-1α靶基因HK2蛋白水平(5F-G)。以上结果表明TREM-1的激活可促进常氧条件下巨噬细胞中HIF-1α的稳定性。
六、在巨噬细胞中,HIF-1α介导的糖酵解调控TREM-1诱发NLRP3炎性小体活化
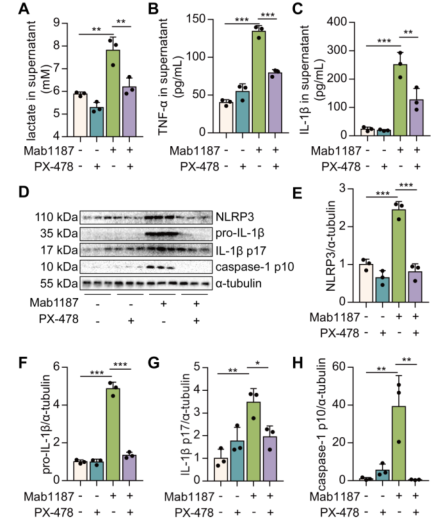
据报道,HIF-1α是免疫和炎症的关键转录调节因子。利用PX-478处理巨噬细胞,去评估HIF-1α对TREM-1诱导NLRP3炎症小体激活的影响。结果显示,抑制HIF-1α减少了TREM-1激活诱导的乳酸生成(图6A), 表明抑制HIF-1α阻断了糖酵解。另外,TREM-1激活诱导的TNF-α生成在巨噬细胞中给药PX-478后生成减少(图6B)。PX-478可降低TREM-1激活巨噬细胞中NLRP3和pro‐IL‐1β的表达(图6D-F)。此外,PX-478还减少了由TREM-1激活引起的IL‐1β分泌(图6C)。HIF-1α抑制剂减弱TREM-1激活的巨噬细胞中caspase-1 p10和IL-1β p17蛋白水平(图6D、G和H)。综上所述,总而言之, HIF-1α在TREM-1介导巨噬细胞NLRP3炎性小体激活起着关键作用。
七、TREM-1的激活通过激活PI3K/AKT/mTOR信号通路促进HIF-1α的积累
文献表明PI3K/AKT/mTOR通路可刺激HIF-1α稳定和转激活域功能。作者发现TREM-1激活可促使巨噬细胞PI3K、AKT和mTOR的磷酸化(图7A-D)。抑制PI3K(LY294002)或mTOR(雷帕霉素)抑制TREM-1激活诱导的乳酸生成和葡萄糖消耗(图7E-F,图7I-J),表明PI3K/AKT/mTOR信号通路对于TREM-1驱动的代谢重编程起重要作用。同时,PI3K或mTOR抑制降低了TREM-1激活诱导的HIF-1α蛋白的表达(图7G-H,图7K-L)。以上结果表明PI3K/AKT/mTOR信号通路在TREM-1激活介导的HIF-1α的积累中起着重要作用。并且,进一步的补充结果说明TREM-1以PI3K/AKT/ mTOR依赖的方式刺激HIF-1α的积累,进而影响NLRP3炎症小体的激活。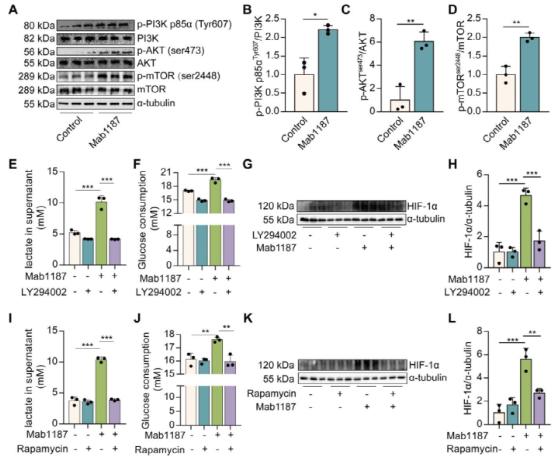
八、TREM-1通过增强巨噬细胞的线粒体裂变来激活NLRP3炎性小体
据报道,线粒体裂变通过降低电子传递链效率抑制了OXPHOS。因此,作者推测TREM-1-抑制的OXPHOS可能参与了巨噬细胞的线粒体裂变。线粒体裂变主要由动力相关蛋白1(DRP1)在丝氨酸616(S616)的磷酸化介导。作者发现TREM-1激活后DRP1 S616磷酸化显著增加(图8A-B)。利用DRP1的抑制剂Mdivi-1处理巨噬细胞,以评估线粒体裂变在TREM-1介导的NLRP3炎性小体激活中的作用。结果显示Mdivi-1可以抑制TREM-1激活诱导的NLRP3和pro‐IL‐1β的表达(图8C-E)。Mdivi-1也减少了TREM-1激活诱导的IL-1β p17的产生(图8C和F)。同时,Mdivi-1也降低了TREM-1激活后巨噬细胞caspase-1 p10蛋白的表达(图8C和G)。以上结果表明TREM-1通过DRP1 S616磷酸化促进线粒体裂变,从而抑制OXPHOS并触发NLRP3炎症小体激活。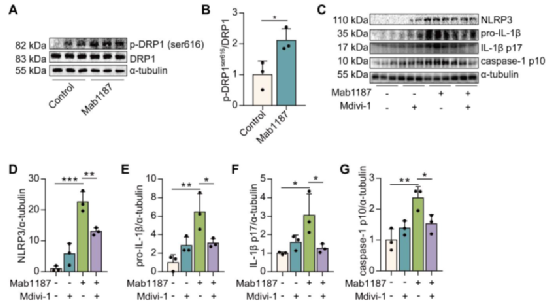
以上就是这篇文献的全部内容,我们最后再来捋一下作者的研究思路:
2-脱氧葡萄糖对糖酵解的抑制降低了TREM-1引发的巨噬细胞NLRP3炎症小体激活。HIF-1α是糖酵解的关键转录调节因子。TREM-1激活通过PI3K/AKT/ mTOR途径促进HIF-1α的积累和转运到细胞核。抑制mTOR或HIF-1α也能抑制TREM-1诱导的代谢重编程和NLRP3/caspase-1激活。总的来说,mTOR/HIF-1α/糖酵解途径是TREM-1控制NLRP3炎性小体激活的一种新机制。在TREM-1激活的巨噬细胞中靶向mTOR/HIF-1α/糖酵解途径可能有利于治疗或预防炎症性疾病,如ALI。
好啦~以上就是本次文献分享的全部内容。我们还为大家搜集了炎性小体相关文献和知识点,以及专属研究方法,感兴趣的小伙伴们可以微信联系:18570028002,我们将会把这些资料发送给大家哦。


 2023-04-19 10:49:35
2023-04-19 10:49:35







