

叮~线粒体和铁死亡的关系了解一下?
 2021-01-20 15:00:36
2021-01-20 15:00:36
来源/作者:普拉特泽生物-医学整体课题外包
Tags: ROS GPX4 pink1—parkin Erastin ferroptosis
从历年国家自然科学基金中标项目分析中我们发现,自从2013年河北医科大学申请到第一项关于“铁死亡”项目后,2014年,2016年都各只有一项“铁死亡”相关项目,从2017年突然增加到15项,2018年急剧增加到37项,2019年50项。
相信2020年与“铁死亡”相关的研究项目会继续成倍增长。各位大大们需要抓住热点啦~
今天小编小姐姐就带大家再来精读1篇铁死亡的高分文献。
文献信息:题目:Role of Mitochondria in Ferroptosis.Molecular Cell ( IF 14.548 ) Pub Date : 2019-Jan-1 , DOI: 10.1016/j.molcel.2018.10.042
Minghui Gao, Junmei Yi, Jiajun Zhu, Alexander M Minikes, Prashant Monian, Craig B Thompson, Xuejun Jiang
当然对细胞铁死亡感兴趣的学者朋友们也可以购买我们普拉特泽生物——春风学院出品的《细胞铁死亡》精品培训课程,购买链接:
• 细胞自噬专题【5课时】:http://weike.fm/Nw7Rw3cd36
• 细胞焦亡专题【5课时】:http://weike.fm/tJaVE18d5d
• 细胞铁死亡专题【5课时】:http://weike.fm/O1JVz187af
• 表观遗传专题【5课时】:http://weike.fm/u3ugE15e9a
• 骨关节炎专题【5课时】:http://weike.fm/PXV1p1cc65
用1杯奶茶的钱,换5节精品课程哦!(点击链接分别跳转至对应专栏)
正文开始
先上一个魔鬼生化必考题:
三羧酸循环(TCA)图解
本文的结论放前边讲:
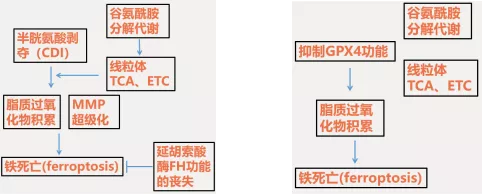
1:本文证明了线粒体在半胱氨酸剥夺诱导的铁死亡中起着关键作用,但在抑制谷胱甘肽过氧化物酶-4(GPX4)诱导的铁死亡中不起作用。
2:在机制上,半胱氨酸缺乏会导致线粒体膜电位超极化和脂质过氧化物积累。
3:抑制半胱氨酸剥夺诱导后线粒体TCA循环或电子转移链(ETC)可减轻线粒体膜电位超极化、脂质过氧化物积累和铁死亡。阻断谷氨酰胺分解具有相同的抑制作用,可通过供应下游TCA循环中间产物可以来抵消该作用。
4:重要的是,延胡索酸酶(FH,一种抑癌剂和TCA循环成分)功能的丧失会使人对半胱氨酸缺乏引起的铁死亡产生抵抗。
5:线粒体在半胱氨酸剥夺诱导的铁死亡中起着关键作用,并与抑制肿瘤中的铁死亡有关。
为方便理解,先来一波名词释义:
铁死亡:铁死亡是一种铁依赖型的调节性坏死,已成为与疾病高度相关的一种新的细胞死亡方式。铁死亡是由于细胞活性氧(Ros)的积累超过了谷胱甘肽(GSH)和以GSH为底物的磷脂氢过氧化物酶维持的氧化还原含量。当细胞抗氧化能力降低,脂质活性氧堆积,就能引起细胞氧化性死亡,即铁死亡。
三羧酸循环:三大营养素(糖类、脂类、氨基酸)的最终代谢通路,又是糖类、脂类、氨基酸代谢联系的枢纽。
Erastin:一种常用的铁死亡诱导剂。合成的小分子化合物Erastin可通过抑制半胱氨酸谷氨酸转运体(system Xc-)的活性而触发铁死亡,导致细胞半胱氨酸和GSH的消耗,从而导致细胞氧化还原稳态的崩溃。
system XC-:胱氨酸/谷氨酸逆转运体(system xc-),调节胱氨酸转运,及谷胱甘肽(Glutathione,GSH)合成的过程中发挥重要作用。
电子转移链(ETC):线粒体中的电子传递链是伴随着营养物质的氧化放能,又称作呼吸链。
pink1—parkin途径:参与膜电位降低引起的线粒体自噬的发生。
CCCP:一种氧化磷酸化抑制剂,导致细胞的逐渐损害以及生命体的死亡,它主要影响线粒体中的蛋白质合成。促使线粒体内膜对H+产生通透性,导致线粒体内膜两侧的膜电位丧失,诱导凋亡发生。
Mito Tracker:活体线粒体染色剂。
CC饥饿:半胱氨酸剥夺饥饿
这里很重要的提示下:

诱发铁死亡的是脂质过氧化物累积,不是胞质ROS!
因此,即使在细胞半胱氨酸和谷胱甘肽含量正常的情况下,清除脂质活性氧所需的酶谷胱甘肽过氧化物酶4(GPX4)失活,也会诱发铁死亡!
铁死亡的诱发途径主要有间接和直接2种。
其中,间接途径为:通过抑制 systemXC阻碍谷胱甘肽的吸收。谷胱甘肽又是 GPXs 发挥作用的必要辅助因子,因此能够导致 GPXs 的活性降低,细胞抗过氧化能力降低,最终导致脂质活性氧堆积,引起细胞的氧化性死亡,即铁死亡。
直接途径为:直接抑制GPX4活性,致细胞抗氧化能力下降,脂质活性氧上升,最终引起铁死亡。
不管是哪种途径,最终都是通过直接或间接影响谷胱甘肽过氧化物酶 GPXs的活性而降低细胞抗氧化能力,致使脂质过氧化反应增加,脂质ROS增多,从而引发铁死亡。
写了这么多,是不是看着很累,来,可爱的小编图也给你画好了。
间接途径 直接途径
下面我们来过一下这篇文章的结果
Fig1 线粒体调节半胱氨酸剥夺引起的铁死亡
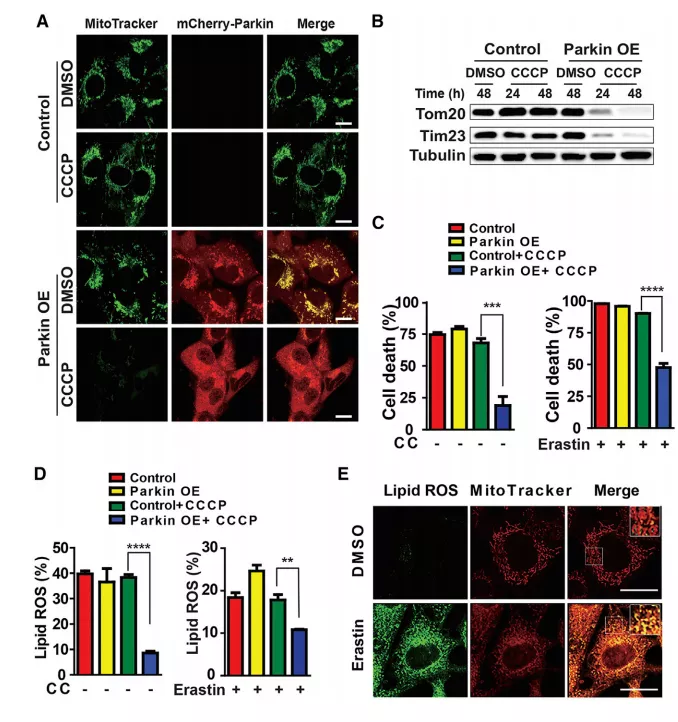
1. CCCP处理后,在无CCCP培养基中恢复24小时后,Parkin过表达细胞中的线粒体明显消失(图1a、b)。看不懂专业名词的往上翻“名词释义”哟~
2.Parkin过表达、线粒体缺失的细胞对半胱氨酸(CC)饥饿或Erastin引起的铁死亡不太敏感(图1c),证实线粒体促进CDI诱导的铁死亡。
3.在CC饥饿或Erastin处理后,线粒体缺失的细胞脂质活性氧积累水平降低(图1d)。
4.在Erastin处理的HT1080人纤维肉瘤HT1080细胞和小鼠胚胎成纤维细胞(MEFs)中,氧化探针首先出现在显著与线粒体共定位,然后在晚些时候与质膜共定位的分布(图1e、S1)。
Fig2 线粒体TCA循环参与半胱氨酸剥夺诱导(CDI)的铁死亡
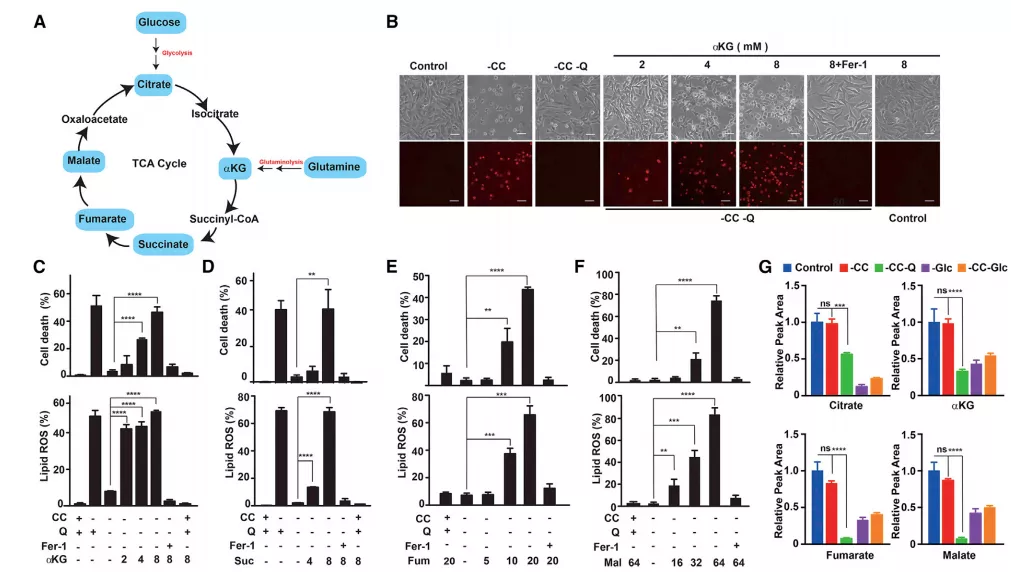
谷氨酰胺代谢,是半胱氨酸剥夺诱导(CDI)的铁死亡所必需的,而谷氨酰胺分解的主要功能之一,就是促进线粒体的三羧酸(TCA)循环(图2a)。
α-酮戊二酸(aKG)是紧接着谷氨酰胺分解的,下游的TCA循环代谢产物,可以取代谷氨酰胺用于CDI诱导的脂质ROS积聚和铁死亡(图2b、2c)
Q, L-glutamine:谷氨酰胺,缺乏抑制铁死亡
CC, L-cystine :半胱氨酸,缺乏诱导铁死亡
Fer-1:铁死亡抑制剂
aKG下游的TCA代谢物,包括琥珀酸(Suc)、富马酸(Fum)和苹果酸(Mal),都可以替代谷氨酰胺在CC饥饿或system Xc-抑制引起的脂质ROS积累所致铁死亡中的作用(图2d-2f)。
整个fig2阐述一个问题:单靠CC饥饿不会改变TCA循环代谢物的水平。而在没有谷氨酰胺的情况下,包括aKG、Fum和Mal在内的多种TCA循环代谢物的水平均显著降低(图2g)。
Fig3 线粒体电子传递链调控半胱氨酸剥夺诱导的铁死亡
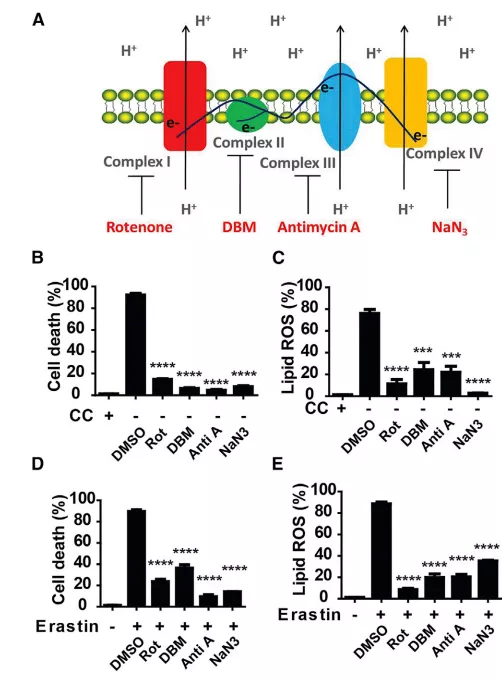
TCA循环最重要的功能之一是支持嵌入线粒体内膜的蛋白质复合物的电子传递活性。那么,由CDI引起的铁死亡是否需要ETC的成分?
如图中结果所示:线粒体复合物i(鱼藤酮)、复合物ii(DBM)、复合物iii(抗霉素)和复合物iv(NaN3)的抑制剂均抑制了由CC饥饿或Erastin引起的脂质ROS积累和铁死亡(图3d-3e)。
这些结果表明,线粒体传递链(ETC)参与了由细胞CDI引起的铁死亡。
Fig4 线粒体膜电位超极化与CDI诱导的脂质积累
线粒体通过质子电化学梯度电位在线粒体膜上积累ROS和铁死亡,产生ATP,这是TCA循环等作用的结果。
以上结果已证实TCA、ETC促进了CDI诱导的铁死亡,这个现象是否与线粒体膜电位的改变也有关呢?
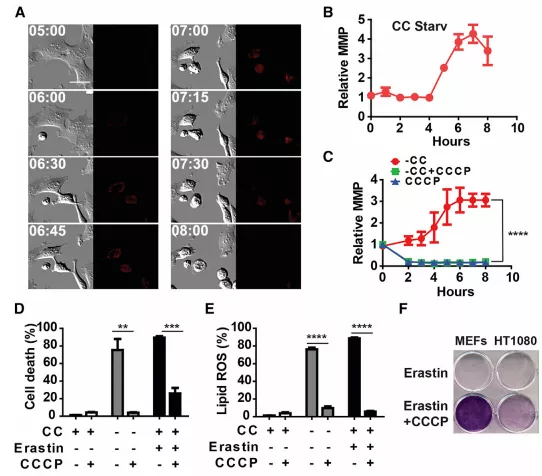
CC饥饿、Erastin等,都能诱导MMP超极化(图4a-4b)。
为了进一步探讨MMP在CDI铁死亡中的作用,作者研究了线粒体解偶联剂CCCP对铁死亡的影响。
如图4c、4d、s4e和s4f所示,CCCP会破坏MMP,完全阻断CDI脂质ROS积聚和铁死亡。此外,根据细胞集落形成试验(图4f),在去除Erastin和CCCP后,增殖得以恢复,这表明CCCP暂时干扰MMP可以防止铁死亡,而不会损害长期细胞生存能力。这一结论与ETC对铁死亡的药理抑制作用一致(图3中的结果)。
Fig5 线粒体功能在GPX4抑制性铁死亡中可有可无
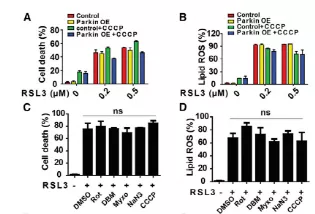
尽管谷氨酰胺分解和线粒体TCA循环/ETC活性有助于CDI诱导的铁死亡,但当这些线粒体活性被破坏时,抑制GPX4或遗传消除仍然可以触发铁死亡。当GPX4抑制剂RSL3触发铁死亡时,线粒体缺失的HT1080细胞没有表现出明显的抵抗力(图5a和5b)。用ETC抑制剂治疗RSL3触发的铁死亡时,不能影响脂质活性氧的积累和铁死亡(图5C、5D)。
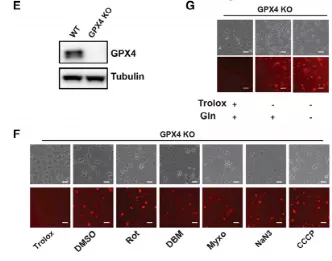
利用CRIPSR/CAS9技术构建GPX4-/-敲除(KO)HT1080细胞,发现ETC抑制剂并不能治疗RSL3诱导的脂质活性氧积聚或铁死亡的情况(图5E、5F)。即使在没有谷氨酰胺的情况下,GPX4抑制诱导的铁死亡也可能发生(图5g)。因此,谷氨酰胺和线粒体功能对GPX4抑制引起的铁死亡不是必要的。
Fig6 线粒体肿瘤抑制因子延胡索酸酶功能丧失导致肾癌细胞对铁死亡的抵抗
TCA循环酶延胡索酸酶(FH)基因的基因突变已在良性和恶性肾癌病变中被证实是肾癌中一种真正的肿瘤抑制因子。
线粒体TCA循环和呼吸作用ETC驱动CDI诱发的细胞铁死亡,作者研究了FH功能的丧失是否使细胞对铁死亡更具抵抗力,从而促进其抑癌作用。
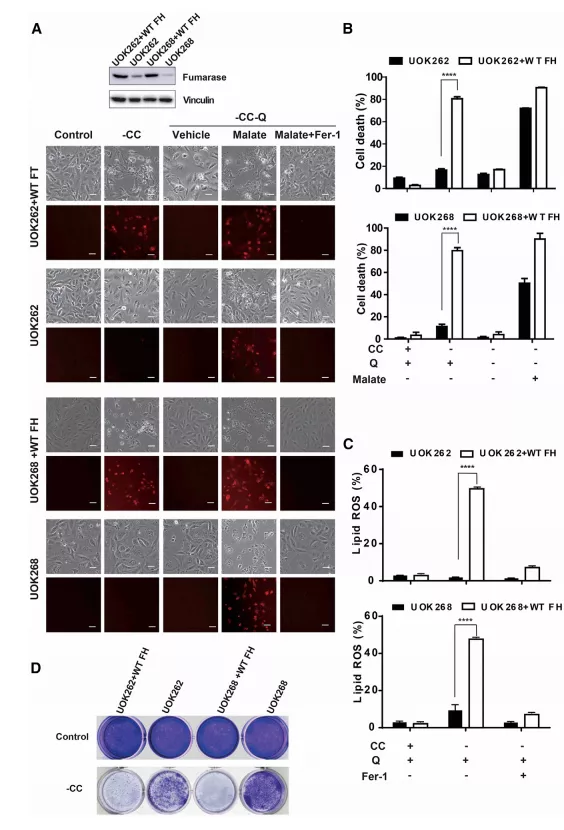
uok262和uok262:病人来源的FH已突变的肾癌细胞系
与表达WT-FH的细胞相比,FH突变体肾癌细胞对CC饥饿诱导的铁死亡不太敏感(图6a-6c)。
这些突变体细胞中的细胞死亡可以通过供应外源性苹果酸来得以改善(苹果酸是TCA循环中FH下游的代谢物(图6a、6b))。
肿瘤细胞的集落形成实验中,FH突变体肾癌细胞在CC饥饿时仍然存活和增殖,而表达WT-FH的等基因细胞在此条件下未能增殖(图6d)。
这些结果表明,在氧化应激(常见于实体瘤的生长环境)下,FH功能的丧失可使癌细胞对铁死亡具有更强的抵抗力,从而具有致瘤优势。
好了,今天的文章就到这里了,有感兴趣的胖友们,记得关注我们的微信公众号-U平台哦么么哒!
