

肝癌细胞中m6A是如何调节癌细胞EMT的
 2021-02-22 09:08:30
2021-02-22 09:08:30
来源/作者:普拉特泽生物-医学整体课题外包
相信很多浸泡在实验室的科研打工人都遇到过类似的问题:
转一个质粒或对细胞加药处理后,同一个基因的mRNA水平和蛋白水平出现了截然不同的趋势:
有的mRNA水平变高了,蛋白水平却变低;
有的mRNA水平变低,蛋白水平又变高了。
所以就陷入了无限循环的筛靶验证或重复实验中
。。。
但其实这是一种相对常见的现象,
真核生物的转录后和翻译后修饰非常复杂,而我们的认知不足以了解微观世界的一切。
背景知识
m6A(N6-methyladenosine,N6-甲基腺嘌呤)是常见的一种转录后修饰,介导了超过80%的RNA甲基化。
然而细胞内部环境复杂,不同mRNA的m6A修饰、不同细胞环境下的m6A修饰,都发挥了不同的生物学功能,需要大家深入探索并摸索规律,因此它也是表观遗传学的热点!hot!
今天小编要给大家分享的是2019年发表于《Nature Communications》(IF:13)上的一篇文章,作者使用大量的分子互作技术(RIP、CoIP、双荧光素酶实验等)探讨肝癌细胞中m6A是如何调节癌细胞EMT的。

为了便于大家理解,小编呕心沥血做了一个本文的思路导图:
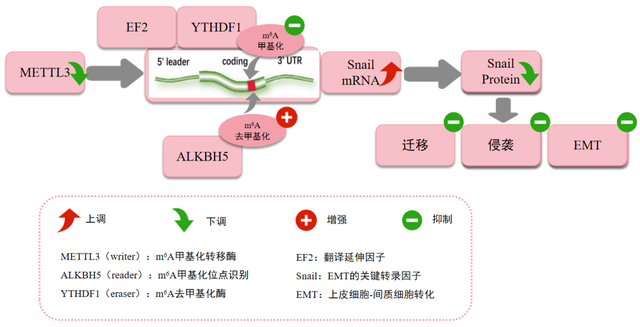
作者揭示,在肝癌细胞转移的一个重要步骤—上皮-间质转化(EMT)过程中,m6A修饰的mRNA在癌细胞中增加。m6A的Writer基因METTL3的抑制下调了肝癌细胞中m6A的修饰丰度。作者还发现,Snail是EMT的关键转录因子,Snail CDS区中的m6A而不是3’UTR区的m6A触发了肝癌细胞中Snail mRNA的多核糖体介导的翻译。这项研究突出了m6A在调节肝癌细胞EMT中的关键作用。
结果解析(重点已经给大家加粗高亮显示了哦)
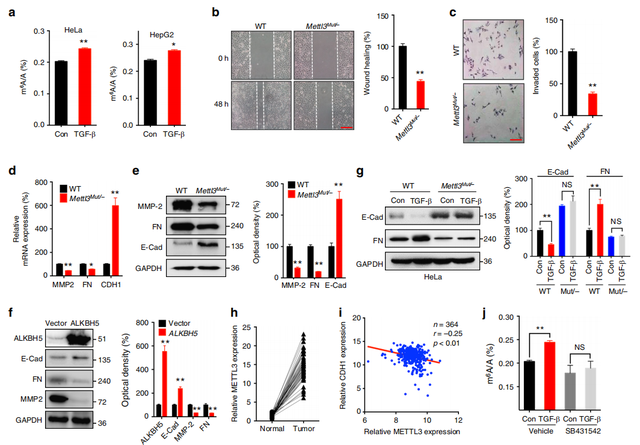
Fig1. 癌细胞的EMT(上皮-间充质转化)受mRNA的m6A水平调节
作者使用TGF-β诱导Hela/HepG2细胞发生EMT(补充图片里面证明了TGF-β诱导后发生EMT进程),之后使用LC-MS/MS的方法对其进行m6A的检测,发现TGF-β诱导组的m6A水平显著高于对照组(a),由此说明癌细胞EMT的发生伴随mRNA的m6A水平增高。甲基化转移酶(writers)在m6A的发生中是必不可缺的,作者之后对Hela细胞的METTL3(writers的一种)进行敲除(Mettl3Mut/− HeLa)。
Mettl3Mut/− HeLa的迁移能力以及侵袭能力显著低于Mettl3Mut HeLa(b-划痕实验,c-Transwell侵袭实验)。Mettl3Mut/− HeLa组的MMP2和FN(间充质细胞的标记物)的mRNA和蛋白水平显著低于Mettl3WT HeLa,而E-cad(与侵袭转移能力呈负相关)的mRNA和蛋白水平显著高于Mettl3WT HeLa(d,e,g),说明METTL3的敲除可抑制癌细胞的EMT进程。
为了验证m6A水平在EMT中的作用,作者进行了ALKBH5(关键的m6A去甲基酶)过表达,发现ALKBH5过表达处理与METTL3敲除处理结果一致(MMP2、FN下调,E-cad上调)(f)。TCGA数据库分析结果显示肝癌组织中的METTL3显著高于正常组织(h),且肝癌组织中 CDH1(E-cad的基因名)的表达与METTL3的表达呈负相关关系(i)。
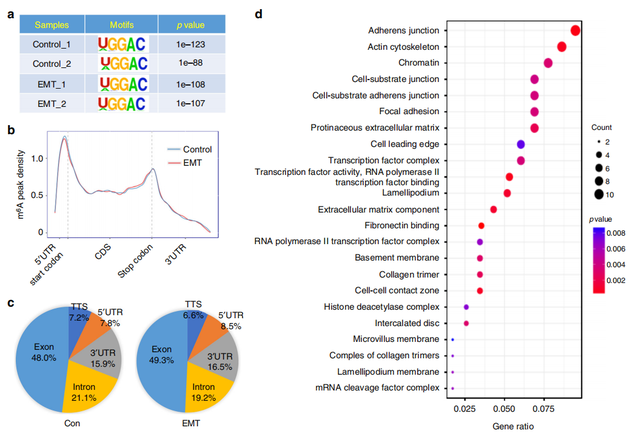
Fig2. 在经历EMT的细胞中m6A调节的基因的变化
确认m6A在EMT中存在调控功能,那具体是哪个基因起到中间作用了呢?作者对EMT 前后细胞进行m6A-seq。在对照和EMT细胞中,GGAC基序都高度富集在m6A位点内(a)。起始和终止密码子附近的m6A峰特别丰富,且主要集中在外显子区域(b,c)。作者将对照与EMT细胞进行比较,鉴定出128个发生了1.5倍的m6A变化的基因。GO分析表明少数基因与经历EMT的癌细胞中粘附连接和肌动蛋白细胞骨架的形成有关(d)。 综上,m6A修饰发生在少数与EMT期间的细胞连接,粘附和迁移有关的基因上。
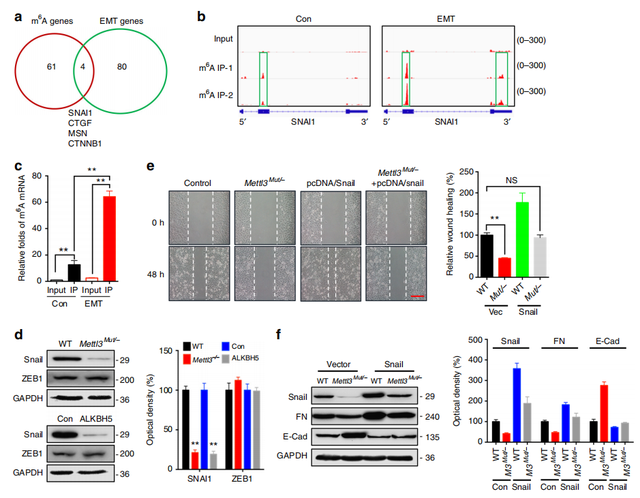
Fig3. 在癌细胞中,Snail参与m6A调控EMT进程
为了找到涉及癌细胞的m6A调控EMT的潜在靶点,作者鉴定了84个具有关键功能的EMT相关基因与61个m6A调控基因(大于2.0倍m6A变化)之间进行Overlap分析,发现4个基因在EMT前后 m6A 和表达水平发生了显著变化(a,b)。其中Snail是一个已知调控EMT 的转录因子,因此作者接下来将研究的重点放在 Snail 上。作者进行m6A RIP- qPCR,EMT组的SNAI1 mRNA的m6A水平显著高于对照组(2.3倍)(c)。与control组相比,METTL3敲除组以及ALKBH5过表达组的Snail表达水平显著降低(d)。由此确认Snail同时受到METTL3(m6A甲基转移酶)和ALKBH5(m6A甲基位点识别蛋白)的调控,即Snail的表达水平受m6A 的修饰水平调控。随后,作者对Snail在EMT中的功能进行了验证,显示Snail 可以促进 EMT 的发生,且Snail 过表达可回补METTL3缺失引起的EMT进程减缓(e,f)。
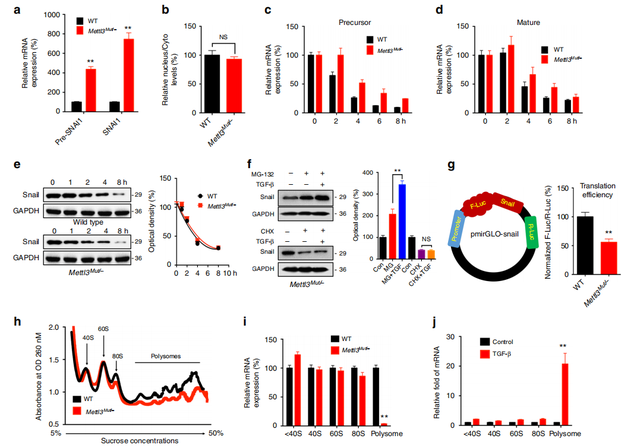
Fig4. 在癌细胞中,m6A触发Snail mRNA的翻译
前面已经证明Snail受m6A修饰调控,那调控具体发生在什么水平呢?qPCR验证发现 METTL3敲除之后,pre-mRNA和mature mRNA的表达水平显著升高(这一点结果与图3d的蛋白表达水平结果相反),且两者的稳定性也显著升高(a,c,d);但是Mettl3Mut /-细胞中Snail蛋白水平下调,Snail蛋白的稳定性在野生型和Mettl3Mut /-HeLa细胞之间无显著差异(e),这表明m6A使得Snail mRNA稳定性降低而不影响其蛋白稳定性。在CHX(蛋白质翻译抑制剂)而非MG-132(蛋白酶体活性抑制剂)的存在下,Mettl3Mut /-HeLa细胞中TGF-β诱导的Snail表达减弱(f)。之后作者构建了pmirGLO-Snail荧光素酶报告载体,结果显示Snail在Mettl3Mut /-HeLa细胞中的翻译效率明显低于HeLa WT细胞中的翻译效率(g)。综上表明m6A诱导的Snail表达与翻译调控有关。
核糖体分析结果显示,与HeLa WT细胞相比Mettl3Mut /-细胞中80S单核糖体和多核糖体(>80S)的减少(h,i)。qPCR显示Mettl3Mut /-细胞翻译活性多核糖体(> 80S)中的Snail mRNA显着低于野生型细胞(j)。提示Snail mRNA的翻译水平在EMT过程中得到了改善。
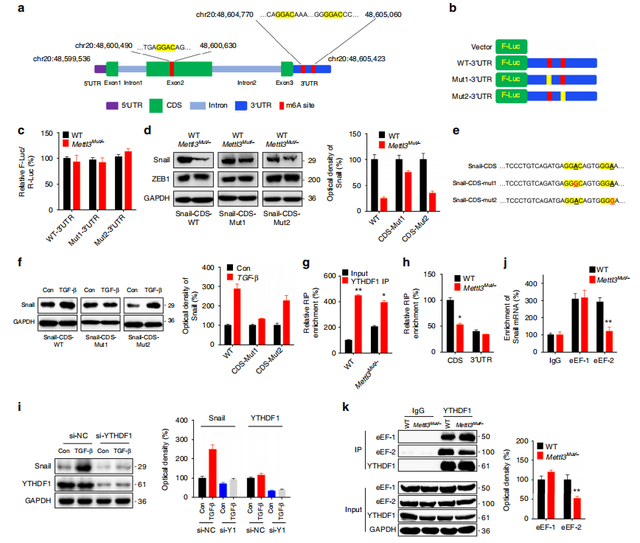
Fig5. m6A-甲基化的CDS调节Snail的翻译
m6A-RIP seq数据显示,在Snail CDS中鉴定出1个GGAC基序,在3'UTR中鉴定出2个GGAC基序(a)。作者使用双荧光素酶实验检测发现野生型和Mettl3Mut /-细胞之间的WT-3'UTR,mut1-3'UTR和mut2-3-3UTR的Snail 3'UTR没有翻译差异(b,c)。表明3'UTR上的m6A甲基化可能不参与m6A修饰调控的Snail表达。之后作者构建了Snail CDS/MUT的表达构建体并进行相关转染实验,结果显示Snail在Mettl3Mut /-细胞中的表达显着下降(而Mut则没有如此明显效果),表明CDS中的m6A甲基化与m6A介导的Snail表达至关重要(d,e,f)。
由于YTHDF1可充当m6A“阅读器”,识别m6A甲基化的mRNA,并促进其靶标的翻译。作者使用RIP-qPCR研究了Snail mRNA和YTHDF1之间的相互作用。结果显示,YTHDF1显着富集了Snail mRNA(CDS区),而在Mettl3Mut /-细胞中,这种相对富集(IP与input)显着受到抑制(g,h)。si-YTHDF1减弱了HeLa细胞中TGF-β诱导的Snail表达(i)。综上证明YTHDF1参与SNAI1 mRNA的m6A甲基化。
接着使用RIP-qPCR检测HeLa细胞中eEF-1-和eEF-2(翻译延伸因子)结合Snail mRNA的变化。与Mettl3WTHeLa相比,Mettl3Mut /-HeLa细胞中Snail mRNA和eEF-2之间的结合显着减少(j)。CoIP分析表明,与Mettl3WTHeLa相比,Mettl3Mut / -HeLa细胞中的YTHDF1和eEF-2之间的结合显着降低(k)。综上表明YTHDF1和eEF-2可能是癌细胞中m6A诱导的Snail mRNA的翻译延伸的原因。
综上,METTL3使 Snail mRNA不稳定且降解而蛋白水平上调。究其原因可能是因为翻译延伸效率提高的原因,使得叠加调控结果为对Snail蛋白水平起正调控的作用。
(这一点在我们在日常的实验中也会经常遇到,所以先不要总是怀疑自己的数据,如果做了几次重复仍然是一样的结果,那么我们要接受它,并尝试找出其它原因。)
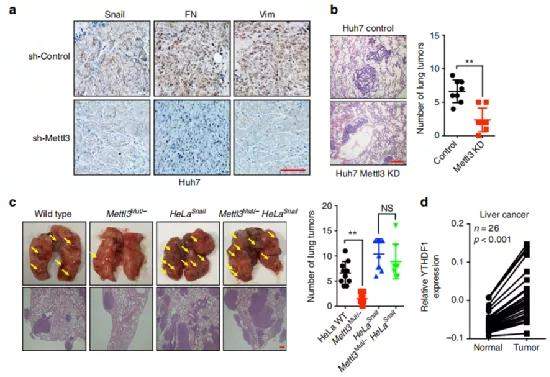
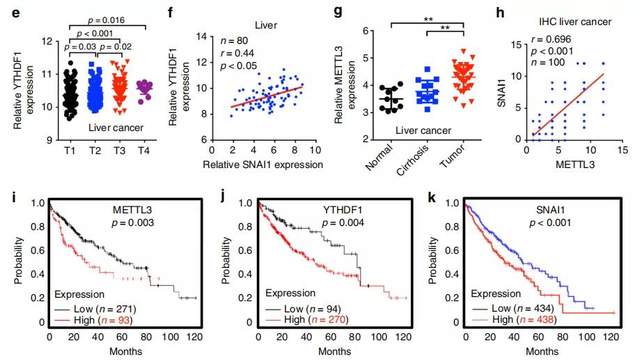
Fig6. m6A调节体内癌症的进展
之后作者研究了m6A甲基化对癌细胞体内转移的潜在影响。作者将sh-Con和sh Mettl3 Huh7细胞分别皮下注射到雌性裸鼠中。IHC结果表明METTL3耗竭使异种移植肿瘤组织中的Snail,FN和Vim含量降低(a),表明METTL3敲降可以降低Huh7细胞的EMT潜力和Snail表达。为了进一步确定m6A甲基化对体内转移的影响,作者进行了肺转移分析。与对照细胞相比,从METTL3 sh Huh7细胞衍生的肺肿瘤数目显着减少(b),表明METTL3缺乏抑制了体内肿瘤转移。然后将HeLa WT、Mettl3 Mut /-HeLa、HeLa Snail、HeLa Snail+Mettl3-注入裸鼠尾静脉静脉注射,结果显示与HeLa WT细胞相比,源自Mettl3Mut /-HeLa细胞的肺的肿瘤数量明显减少,而Snail的过度表达可以减弱Mettl3Mut /-HeLa细胞对体内肺转移的抑制作用(c)。提示Snail参与了METTL3的体内转移作用。
最后的最后,作者进行了临床数据的统计分析,发现与癌旁组织相比,在肝肿瘤组织中观察到METTL3(h)和YTHDF1(d)表达增加,且与肝脏中的Snail mRNA水平正相关(f,g)。高METTL3(i),YTHDF1(j)和SNAI1(k)表达的肝癌患者显示总生存期(OS)降低。
