扎西他滨诱导细胞自噬依赖性铁死亡原理——解读《Autophagy》
 2021-07-13 17:44:52
2021-07-13 17:44:52
来源/作者:普拉特泽生物-医学整体课题外包

自噬和铁死亡的关系,最经典的当属自噬过程对铁蛋白的吞噬会释放大量的Fe2+,增加胞质内的不稳定铁池,从而促进铁依赖性的死亡方式。简单概述为“自噬——铁流——铁死亡”的作用机制。
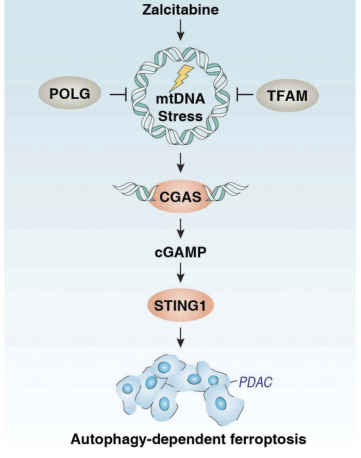
《Autophagy》杂志揭示了另一种“mtDNA应激——自噬——铁死亡”机制。

译:线粒体DNA应激触发自噬依赖性铁死亡
Autophagy ( IF :9.770/Q1 ) DOI: /10.1080/15548627.2020.1739447

需要注意的是,铁死亡过程的标志为细胞质和脂质活性氧增多、线粒体变小以及线粒体膜密度增大,且Fe2+参与其中。
![]()
本文的结论放前边讲:
在结论上,作者发现了:
扎西他滨(一种抗人类免疫缺陷病毒感染的抗病毒药物),可以通过诱导铁死亡来抑制原发性和永生化人胰腺癌细胞的生长。
在机制上,作者发现了:
这种效应依赖于扎西他滨诱导的线粒体DNA应激,该应激激活STING1/ tmem173介导的DNA传感通路,通过脂质过氧化导致巨自噬/自噬依赖的细胞铁死亡,而不受I型干扰素的影响。
在研究意义上,作者认为:
这些发现不仅为胰腺癌的治疗提供了一种新的方法,而且增加了我们对细胞自噬和DNA损伤反应在细胞死亡过程中相互作用的认识。
这篇文章具体结果如下:
研究背景文字
研究结论文字
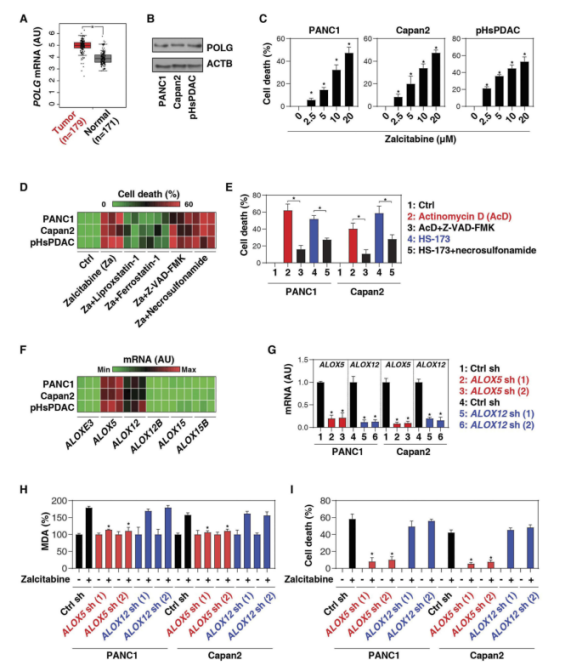
1.扎西他滨诱导胰腺癌细胞ALOX5依赖性铁死亡
通过前期的研究表明,扎西他滨除了抗病毒作用,还可以诱导白血病、黑色素瘤或脑癌细胞的死亡。为了确定扎西他滨与癌症细胞的关系,作者选择了用致死率最高的一种癌症,胰腺癌作为目的细胞研究。
生信分析发现在肿瘤组中,Polg的表达是显著上调的,而Polg是扎西他滨的药物靶标线粒体DNA复制和修复调节因子(图1 A-B)。为了研究polg为潜在的治疗靶点,作者用扎西他滨处理肿瘤细胞后发现扎西他滨呈剂量依赖性诱导胰腺癌细胞死亡(图1 C)。通过加入铁死亡抑制剂和敲除ALOX家族,作者发现抑制铁死亡后可以阻断扎西他滨诱导的细胞死亡(图1 D-E)通过实验进一步证实,敲除了ALOX5可以阻断扎西他滨诱导的丙二醇的产生,丙二醇为脂质过氧化的标志物,所以可以证明:
扎西他滨通过脂质氧化作用触发了ALOX5依赖的细胞铁死亡
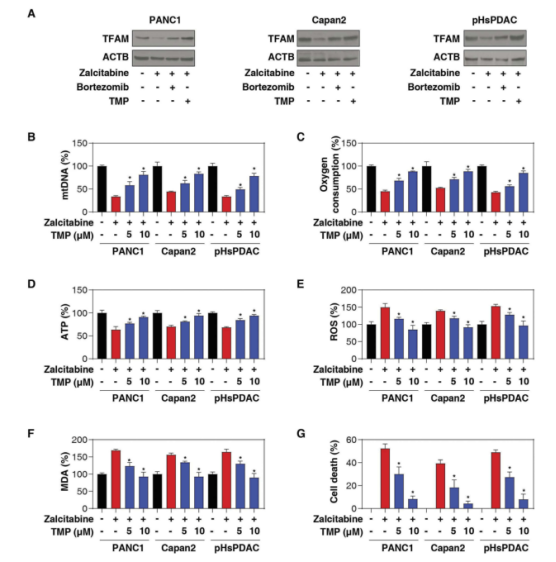
2.扎西他滨诱导的TFAM降解促进铁死亡
除了Polg,线粒体DNA的复制还需要TFAM(线粒体转录因子)。Polg和TFAM之间的相互作用和反馈决定了不同类型细胞中mtDNA的稳态。因此作者又对TFAM进行了研究。
通过WB实验发现扎西他滨加入可以降低TFAM蛋白的表达,而TMP(抑制TFAM降解的药物)可以使其逆转。通过研究线粒体蛋白酶LONP/Lon,发现TMP与TFAM结合后,通过LONP1阻断其降解。这些发现与以前的研究一致,表明LONP1途径是线粒体DNA应激过程中TFAM降解的主要机制。
Polg或TFAM基因的缺陷会降低线粒体DNA拷贝数,导致呼吸链紊乱、线粒体功能障碍和氧化应激。接下来,作者将线粒体DNA应激和铁死亡联系起来。正如预期的那样,扎西他滨治疗导致线粒体功能障碍,包括线粒体DNA拷贝数的减少(图2D),氧耗减少(图2E),ATP生成受限(图2F),以及总活性氧生成增加。相反,在原代和永生化的PDAC细胞中,观察到TMP(抑制TFAM降解的药物)对扎西他滨诱导的线粒体功能障碍有保护作用(图2D-G)。TMP还抑制扎西他滨诱导的MDA产生(图2H)和细胞死亡(图2I)。这些发现表明:
阻止TFAM降解可以通过恢复线粒体功能来限制扎西他滨诱导的铁死亡。
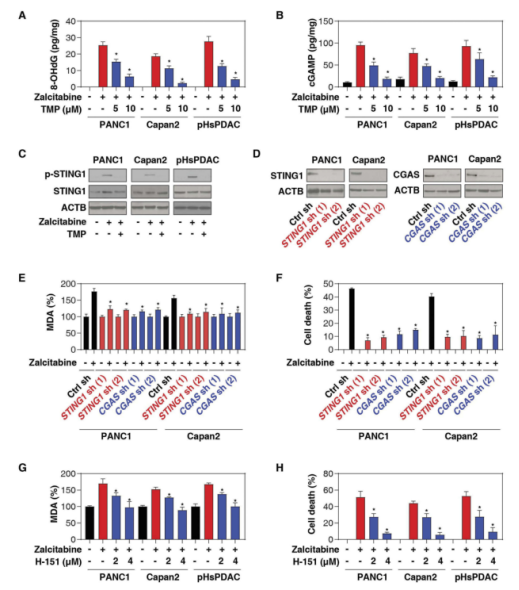
3.CGAS-STING1通路促进扎西他滨诱导的铁死亡
自从TFAM被发现以来,许多研究表明TFAM的缺失参与了DNA损伤和传感通路的激活。特别是,TFAM基因的丢失增加了线粒体DNA应激、损伤和胞浆释放,在感染过程中通过激活cGAS(环状GMP-AMP合成酶)-STING1通路而导致抗病毒的先天免疫反应。目前还不清楚在扎西他滨诱导的癌细胞铁死亡中是否发生了类似的信号转导。
作者研究了8-羟基脱氧鸟苷(氧化DNA损伤的标志)、包浆线粒体DNA、cGAMP和磷酸化STING1的水平,发现扎西他滨诱导的TFAM降解可以触发DNA氧化损伤,线粒体DNA释放到胞浆,进而激活cGAS-STING1通路,这表明扎西他滨诱导的TFAM降解可以触发DNA氧化损伤,线粒体DNA释放到胞浆中,进而激活cGAS-STING1通路。
为了确定该通路与铁死亡直接挂钩,作者发现抑制了STING1可以阻断扎西他滨诱导的MDA产生,结果表明:
cGAS-STING1传感通路促进了扎西他滨诱导的脂质过氧化和铁死亡。