

线粒体相关研究总结
 2021-06-11 11:33:18
2021-06-11 11:33:18
来源/作者:普拉特泽生物-医学整体课题外包
线粒体功能的研究背景
线粒体除了作为细胞内能量生成的关键细胞器,还参与细胞凋亡、自由基生产、脂质代谢等代谢过程。一些研究报道指出,线粒体功能异常会导致许多常见疾病的病理,包括神经退化、代谢疾病,心脏衰竭,缺血再灌注损伤和原生动物的感染等。因此,线粒体是这些高度流行疾病的一个重要药物靶点。一些旨在治疗性恢复线粒体功能的策略正在出现,少数药物已进入临床试验。
线粒体与疾病的关系
再灌注损伤当流向器官的血液被打断时,就会发生缺血,使器官失去氧气和外部代谢物的供应,导致乳酸、琥珀酸的堆积。此时含氧血液再灌注入器官,会导致琥珀酸氧化,产生ROS,致使氧化损伤。且同时ROS与线粒体内富集的Ca2+共同作用于MTPTP,会致使线粒体肿胀,细胞死亡,从而引发炎症(如下图)。
因此,减缓再灌注损伤有以下方案:在缺血时,预防琥珀酸积累;在再灌注时,避免琥珀酸氧化,减少ROS生成,或添加氧化剂,避免氧化损伤;及再灌注后,注射阻断MPTP通路相关药物,避免细胞死亡,或直接注射抗炎药物等方式,防治再灌注损伤。但是应用于临床结果令人失望,分析其原因可能是动物实验使用的模型过于年轻,缺乏老年人,不健康患者的相关共性。或是患者同时服用多种药物,与被检测药物可能效果相似,导致无法正确评估药效。还有可能是治疗前缺血时间太长或太短,影响判断结果。另外,CSA药物进入线粒体速度太慢,无法阻止细胞损伤,需要迅速给药。

1、肥胖
减肥是一个相当热门的话题,通过线粒体,促进脂肪代谢来提供能量,能够有效的治疗肥胖。细胞的线粒体中会产生三磷酸腺苷(ATP)分子,它能够为身体提供能量。20世纪30年代曾经流行过一种减肥药——2,4-二硝基苯酚(DNP),它会阻断这一过程,导致线粒体产生热量而非ATP,并促使细胞代谢碳水化合物和脂肪。后来多人由于过热死亡,DNP在1938年被废止使用。近来有研究发现,DNP甲基醚能在肝脏中被代谢为DNP,从而减少脂肪肝与高血脂的症状。
2、胰岛素耐受
即不能正常降低血糖。可以通过线粒体为靶点的治疗手段有:使用二甲双胍,抑制氧化磷酸化过程中的复合物I,使ADP:ATP的比值上调,从而激活AMPK,延缓肝脏糖异生的反应;通过NMN,使NAD+水平上调,改善II型糖尿病;通过减少线粒体ROS的生成,或使用抗氧化剂,恢复胰岛素,且减少糖尿病并发症。
3、高血压
线粒体内的超氧化物与血管舒张剂NO反应,导致血管收缩,造成高血压;或ROS导致细胞外弹性蛋白酶被氧化损伤,从而会导致高血压。有研究表明,利用抗氧化剂MitoQ有望通过阻止ROS损伤来治疗高血压。
4、脂肪肝
非酒精性脂肪肝(NAFLD)是与肥胖相关的疾病,NAFLD的治疗选择有限,肝移植是肝硬化的唯一可能。但脂肪在肝脏的积累是NAFLD的关键驱动因素,这可以通过DNP衍生物诱导肝内线粒体选择性解耦从而增强线粒体脂肪氧化从而解决。此外,线粒体损伤与NAFLD的发展密切相关,氧化应激升高,NAD+耗竭。可通过抗氧化剂MitoQ及NMN补充NAD+,作为一种治疗手段。
5、神经衰退型疾病
亨廷顿病、家族性帕金森病、阿尔茨海默病、肌萎缩性脊髓侧索硬化症等疾病被认为是与线粒体损伤相关的疾病。许多类型的线粒体功能障碍与神经退行性变有关,包括氧化损伤、ATP合成缺陷、NAD+耗尽、线粒体动力学和质量控制受限、钙稳态紊乱。可以通过对这些方面的调节作为一种治疗手段。
已有大量的动物和人类数据表明,靶向线粒体是一种减缓神经退行性疾病进展的良好策略。但运用于临床是失败的,导致治疗失败的一个可能因素是,当神经退行性疾病的患者被招募参加临床试验时,已经是晚期,无法治疗。而在许多动物研究中,治疗是在临床出现明显症状之前进行的。并且与此相关的许多神经退行性疾病过程可能构成一个恶性循环,一旦细胞损伤开始,其他因素,如炎症和血管损伤,都会导致一系列的反应。因此,当疾病出现症状时,在线粒体水平进行干预可能已经太晚了。
6、视网膜功能性障碍
视网膜感光细胞(RPCs)受损或丧失是西方国家最常见的视力丧失原因,依赖于氧化磷酸化和高水平的氧化应激使视网膜非常容易受到线粒体功能障碍的影响,这表明专注于这个细胞器的治疗是有益于视网膜功能性障碍的改善的。动物模型的研究结果支持了这一观点,即RPC死亡与NAD+耗竭有关,导致SIRT3活性下降, 通过NMN补充NAD+能减少这种细胞的损失。
7、心力衰竭(HF)
心脏供血需要能量,它依靠线粒体ATP的产生来驱动心肌细胞收缩,并重新分配释放的钙来启动这一过程。因此,线粒体功能障碍是心衰的一个关键组成部分。导致心力衰竭与线粒体功能障碍相关的因素有多种,但ROS的产生升高、氧化损伤、线粒体生物发生缺陷是最为常见的,机制尚不清楚,且通过抗氧化剂的临床效果不佳。寄希望于保护线粒体或增加线粒体作为目标的治疗,是未来发展的领域。
8、寄生虫
原生动物感染导致了许多医学、社会和经济上的重要疾病,包括疟疾、布鲁氏锥虫和查加斯病(克鲁兹锥虫)。由于缺乏疫苗、药物毒性和出现耐药性,研制治疗这类寄生虫病的新疗法是一个迫切需要得到满足的领域。原生动物线粒体是一个有吸引力的药物靶点,因为它们的线粒体不仅对生存至关重要,而且与哺乳动物宿主的线粒体也有很大的不同。
由于恶性疟原虫缺乏嘧啶挽救途径,它们依赖于线粒体DHODH途径生产嘧啶,因此,DHODH本身就是一个潜在的药物靶点。然而另外一个药物靶点,Atovaquone在细胞色素bc1复合物上的结合位点,位于线粒体DNA上,因此容易发生氧化损伤和基因突变,从而使寄生虫容易获得抗性。所以通过抑制ND2,位于核基因组上的编码蛋白,作为靶点治疗效果更好。
锥虫的线粒体是一个很有吸引力的药物靶点,因为它们有不同的代谢模式,这取决于宿主和生命周期的阶段,并且与人类线粒体不同。寄生虫感染的人血液的阶段是依赖糖酵解产生ATP,它包含一个线粒体,该线粒体具有一个非常规的呼吸链,对于从NADH再生NAD+以维持糖酵解至关重要,而人体内AOX的缺乏使其成为一个有吸引力的药物靶点(如下图)。

线粒体的功能介绍
1、能量转化
线粒体是真核生物进行氧化代谢的部位,是糖类、脂肪和氨基酸最终氧化释放能量的场所。线粒体负责的最终氧化的共同途径是三羧酸循环与氧化磷酸化,分别对应有氧呼吸的第二、三阶段。细胞质基质中完成的糖酵解和在线粒体基质中完成的三羧酸循环在会产还原型烟酰胺腺嘌呤二核苷酸(reduced nicotinarnide adenine dinucleotide,NADH)和还原型黄素腺嘌呤二核苷酸(reduced flavin adenosine dinucleotide,FADH2)等高能分子,而氧化磷酸化这一步骤的作用则是利用这些物质还原氧气释放能量合成ATP。在有氧呼吸过程中,1分子葡萄糖经过糖酵解、三羧酸循环和氧化磷酸化将能量释放后,可产生30-32分子ATP(考虑到将NADH运入线粒体可能需消耗2分子ATP)。如果细胞所在环境缺氧,则会转而进行无氧呼吸。此时,糖酵解产生的丙酮酸便不再进入线粒体内的三羧酸循环,而是继续在细胞质基质中反应(被NADH还原成乙醇或乳酸等发酵产物),但不产生ATP。所以在无氧呼吸过程中,1分子葡萄糖只能在第一阶段产生2分子ATP。
2、三羧酸循环
糖酵解中生成的每分子丙酮酸会被主动运输转运穿过线粒体膜。进入线粒体基质后,丙酮酸会被氧化,并与辅酶A结合生成CO2、还原型辅酶Ⅰ和乙酰辅酶A。乙酰辅酶A是三羧酸循环(也称为“柠檬酸循环”或“Krebs循环”)的初级底物。参与该循环的酶除位于线粒体内膜的琥珀酸脱氢酶外都游离于线粒体基质中。在三羧酸循环中,每分子乙酰辅酶A被氧化的同时会产生起始电子传递链的还原型辅因子(包括3分子NADH和1分子FADH2)以及1分子三磷酸鸟苷(GTP)。
3、氧化磷酸化
NADH和FADH2等具有还原性的分子在电子传递链里面经过几步反应最终将氧气还原并释放能量,其中一部分能量用于生成ATP,其余则作为热能散失。在线粒体内膜上的酶复合物(NADH-泛醌还原酶、泛醌-细胞色素c还原酶、细胞色素c氧化酶)利用过程中释放的能量将质子逆浓度梯度泵入线粒体膜间隙。虽然这一过程是高效的,但仍有少量电子会过早地还原氧气,形成超氧化物等活性氧(ROS),这些物质能引起氧化应激反应使线粒体性能发生衰退。在此过程中产生的ROS和一些中间代谢物可作为线粒体的信号,调节相关下游反应;ROS也可能会对线粒体造成氧化损伤;ROS与线粒体内富集的Ca2+共同作用于MTPTP,会致使线粒体肿胀,细胞死亡。
氧化磷酸化代谢过程中的Cytochrome c与细胞凋亡相关。途径大体为:细胞受到凋亡信息刺激后,BH-3 only 亚族蛋白和Bax亚族蛋白相互作用,促使Bax亚族蛋白寡聚化,并进入线粒体,促使线粒体释放Cytochrome c和Smac/DIABLO至胞质中,其中Cytochrome c与胞质中的Apaf-1、ATP/dATP、pro-caspase9结合,形成一个700~1400kDa,具有很强caspase酶激活活性的大分子蛋白复合物,称为凋亡体,它激活caspase-9后,依次激活下游的caspase-3及其他效应caspase,引起凋亡。凋亡不完全是一个线性通路,各凋亡信号分子间相互影响,相互作用,从而有效的调节整个凋亡过程。
4、储存钙离子
线粒体可以储存钙离子,可以和内质网、细胞外基质等结构协同作用,从而控制细胞中的钙离子浓度的动态平衡。线粒体迅速吸收钙离子的能力使其成为细胞中钙离子的缓冲区。在线粒体内膜膜电位的驱动下,钙离子可由存在于线粒体内膜中的单向运送体输送进入线粒体基质;排出线粒体基质时则需要钠-钙交换蛋白的辅助或通过钙诱导钙释放(calcium-induced-calcium-release,CICR)机制。在钙离子释放时会引起伴随着较大膜电位变化的“钙波”(calcium wave),能激活某些第二信使系统蛋白,协调诸如突触中神经递质的释放及内分泌细胞中激素的分泌。线粒体也参与细胞凋亡时的钙离子信号转导。
5、其他功能
除了合成ATP为细胞提供能量等主要功能外,线粒体还承担了许多其他生理功能。调节膜电位并控制细胞程序性死亡:当线粒体内膜与外膜接触位点处生成了由己糖激酶(细胞质基质蛋白)、外周苯并二氮受体和电压依赖阴离子通道(线粒体外膜蛋白)、肌酸激酶(线粒体膜间隙蛋白)、ADP-ATP载体(线粒体内膜蛋白)和亲环蛋白D(线粒体基质蛋白)等多种蛋白质组成的通透性转变孔道(PT孔道)后,会使线粒体内膜通透性提高,引起线粒体跨膜电位的耗散,从而导致细胞凋亡。线粒体膜通透性增加也能使诱导凋亡因子(AIF)等分子释放进入细胞质基质,破坏细胞结构。细胞增殖与细胞代谢的调控;合成胆固醇及某些血红素。
靶向线粒体的治疗方案
线粒体能量代谢的紊乱会导致多种“继发性”线粒体疾病,线粒体导致疾病的常见原因有:
1.ATP:ADP的比率下降,NAD+的量下降,导致信号通路改变;
2.代谢紊乱;
3.产生大量ROS,导致氧化损伤;
4.诱导MPTP通路,使细胞凋亡或死亡;
5.钙离子通道异常(如下图)。
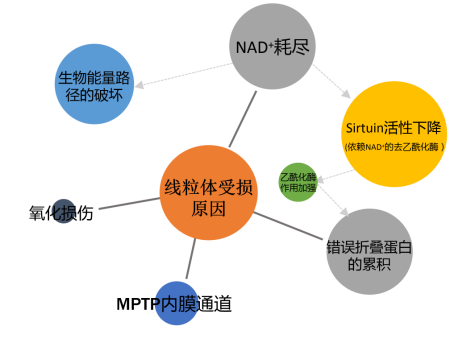
其相对应的靶向线粒体的治疗方案:补充NAM、NMN等来补充NAD+;激活蛋白酶,伴侣蛋白,协助蛋白正确折叠;使用抗氧化剂(S1QELS/S3QELS分别与呼吸链复合酶I/复合酶II结合,抑制ROS生成);使用CsA,阻止MPTP通道引起的细胞凋亡或死亡。以上几个治疗方案是机动联合的,对其中一种进行调节,其他情况均会有所改善。
研究线粒体功能的技术手段
1、增加线粒体数量的调节机制
非直接影响线粒体,而是通过增加线粒体数量与活性,进而增加内膜表面积,增加ATP的产生。利用PPCIα蛋白相关调控机制,来调节线粒体的数量。PGCIα能结合调控NRF1/NRF2、ERRS、CRER1、FOXO、PPAR等多种蛋白。其中NRF1/NRF2能够调控表达多种多肽靶向线粒体,eg:POCG(DNA聚合酶)、DNA解旋酶,其对线粒体分裂生成十分关键。研究表明比格列酮、罗格列酮等抗糖尿病药物,可激活PPAR从而增加PGCIα表达上调,致使线粒体数量增多。另外,使用SIRT1活化剂通过去乙酰化激活PGCIα,从而增多线粒体数量。或者通过抑制线粒体合成抑制通路,增加线粒体数量,如低氧诱导因子。
2、线粒体数量的动态平衡
为适应不同生理功能,细胞内不同区域能量需求不同,线粒体通过分裂和融合的方式,动态变化适应机体需求。当分裂速率>融合速率,则线粒体数量增加;融合速率>分裂速率,则线粒体数量减少,体积增大。其中Drp1、Fis1酶参与线粒体分裂过程,而Mfn1、Mfn2参与线粒体外膜融合,OPA1参与线粒体外膜融合。可以通过调节分裂融合相关蛋白,来调节线粒体的数量,作为一种治疗手段。
3、加强对线粒体质量的把控
加强对线粒体质量的把控可通过增加线粒体自噬的手段来实现,研究表明增强线粒体分裂的药物可能会增加受损细胞器的清除,增加自噬,减少炎症的发生,一种较好的治疗策略。本文介绍了两种方式:AMPK活化,从而增加对Drp1招募,使线粒体分裂,自噬;尿素A刺激自噬的发生,增加肌肉的功能。
4、利用线粒体使细胞致死
线粒体是细胞凋亡与死亡调控过程中的核心部分,其很多特性使其可作为靶点,致死癌细胞、寄生虫。其缺陷是可能导致无选择性的杀死正常细胞。所以,要利用正常细胞与需致死细胞中线粒体之间的差异部分,作为靶点,结合抗癌药物进行治疗;或者通过耗尽抗氧化剂、增加ROS产量,使细胞氧化损伤,从而致死。
5、线粒体作为信号中心
线粒体能向细胞其他部分发出信号,如ATP/ADP、ca2+、NAD+、ROS、代谢物等,如ROS是作为氧化还原反应的信号,调节这些信号也可能成为一种治疗手段。
