

肿瘤细胞中TYRO3 的表达与免疫逃逸及铁死亡机制
 2021-08-13 10:23:53
2021-08-13 10:23:53
来源/作者:普拉特泽生物-医学整体课题外包
生活不缺少美,只是缺少发现美的眼睛。而只要会统计分析,科研就不缺灵感。如这篇发表在期刊The Journal of Clinical Investifgation(IF = 11.864),上标题为TYRO3 induces anti-PD-1/PD-L1therapy resistance by limiting innate immunity and tumoral ferroptosis的文章。
文章用了大量的统计分析结合部分实验,成功揭示了肿瘤细胞中TYRO3 的表达与免疫逃逸及铁死亡机制。


程序性死亡受体配体(PD-L1)与T细胞上的受体PD-1结合,会抑制T细胞活化,引起T细胞凋亡。免疫检查点阻断疗法(ICB)可以通过调节T细胞活性来提高肿瘤免疫反应的治疗方法。但是,由于存在对这种治疗的耐受性,只有大约10%-30%的患者可以从通过阻断PD-1/PD-L1轴功能的ICB疗法中获益。目前有研究发现针对RTKs(受体酪氨酸激酶)的抑制剂可对抗各种恶性肿瘤,可能是克服耐受性的潜在治疗靶点。
另外,有研究表明T细胞诱导的肿瘤细胞铁死亡,有助于PD-L1单抗诱导的肿瘤生长抑制。

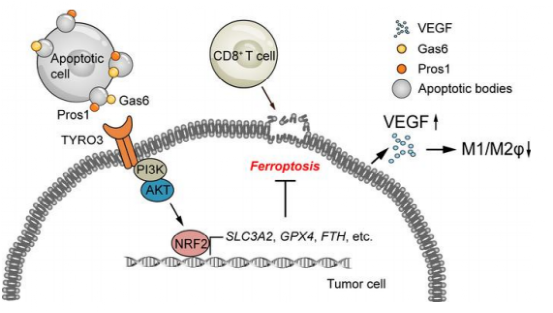
本论文通过大量的统计筛查,在抗PD-1/PD-L1抵抗中起作用的RTKs中最终确定了TYRO3。文章表明TYRO3通过AKT/NRF2轴抑制肿瘤细胞铁死亡,并通过上调VEGF降低巨噬细胞M1/M2比值,维持原肿瘤微环境,促进肿瘤细胞存活,从而导致对ICB疗法的耐受性。
此外,肿瘤细胞可以利用来自邻近死亡细胞的磷脂酰丝氨酸(PS)信号,激活TYRO3。
总结下来,本文的研究思路十分清晰:
1. TYRO3高表达、及磷酸化与抗PD-1/PD-L1治疗的患者预后差相关;
2.TYRO3有利于抗炎TME(肿瘤微环境),使肿瘤细胞能够抵抗ICB疗法;
3.TYRO3通过上调VEGF降低M1/M2的比率,从而促进了原肿瘤的TME;
4.TYRO3通过AKT/NRF2轴抑制肿瘤细胞铁死亡,而肿瘤细胞可利用来自邻近死亡细胞的磷脂酰丝氨酸(PS)信号,激活TYRO3。
5.抑制TYRO3可增强肿瘤细胞铁死亡,使肿瘤对ICB疗法敏感。
机制图
我们一起来看本文的Results部分:
一、在接受抗PD-1/PD-L1治疗的患者中,高TYRO3表达与预后差相关
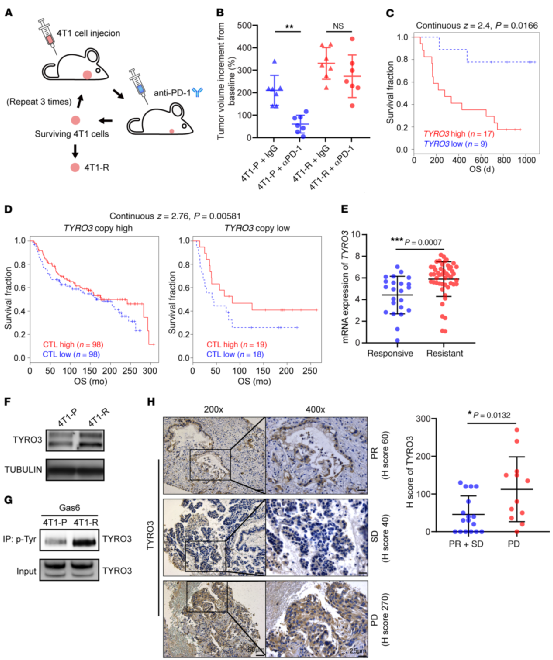
首先,将4T1乳腺癌细胞接种到BALB/c小鼠的乳腺脂肪垫,然后用小鼠抗PD-1(抗mPD-1)抗体治疗,建立抗性模型(4T1-R),4T1-R肿瘤对抗mPD-1治疗没有反应。
随后,筛选可能参与抗PD-1抗性的激酶;通过受体络氨酸激酶抗体阵列筛选(RTKs,细胞信号传导的主要信号酶,也是重要的肿瘤药物靶标),4T1-R细胞中TYRO3、EPHB2、FLT3和TRKA的表达或磷酸化水平高于4T1-P细胞,其中TYRO3的增加最高。
为了验证临床相关性,利用两个数据库:肿瘤免疫功能障碍和排除(TIDE)、基因组学临床结果预测(PRECOG);发现:TYRO3是唯一参与抗PD-1抵抗的肿瘤相关RTK成员,且与多种肿瘤相关。
不仅如此,作者还在数据库中发现:在低TYRO3表达水平的患者中,T细胞高度浸润肿瘤与患者总体生存率的延长相关;但在TYRO3表达水平高的患者中不存在。
而RNA-Seq检测显示:T细胞水平与基因拷贝数高TYRO3患者的延长存活率无关,但确实介导了TYRO3基因拷贝数低患者的延长存活率。表明:TYRO3降低T细胞的肿瘤杀伤作用。
进一步确定TYRO3与抗PD-1治疗结果的相关性:耐药性肿瘤患者TYRO3表达水平明显高于肿瘤有反应的患者(Fig1.E)。
而WB检测:TYRO3、p-TYRO3在4T1-R肿瘤中上调,
免疫组化检测:29例肺癌患者中,耐药患者TYRO3表达显著较高。
综上,患者肿瘤组织中的TYRO3高表达并发生磷酸化,与抗PD-1治疗的耐药性相关。
注:
受体络氨酸激酶RTKs类型:表皮生长因子受体家族EGFRs,血小板衍生生长因子受体家族PDGFRs,神经生长因子受体家族NGFRs成纤维细胞生长因子受体FGFRs,胰岛素样生长因子-1受体家族IGF1Rs,巨噬细胞集落刺激因子受体家族MCSFRs,血管内皮生长因子受体家族VEGFRs胰岛素受体家族INSR,肝细胞生长因子受体家族HGFRs。
二、TYRO3使肿瘤细胞能够抵抗PD-1治疗
那么,TYRO3是否足以引起抗PD-1抗性呢?
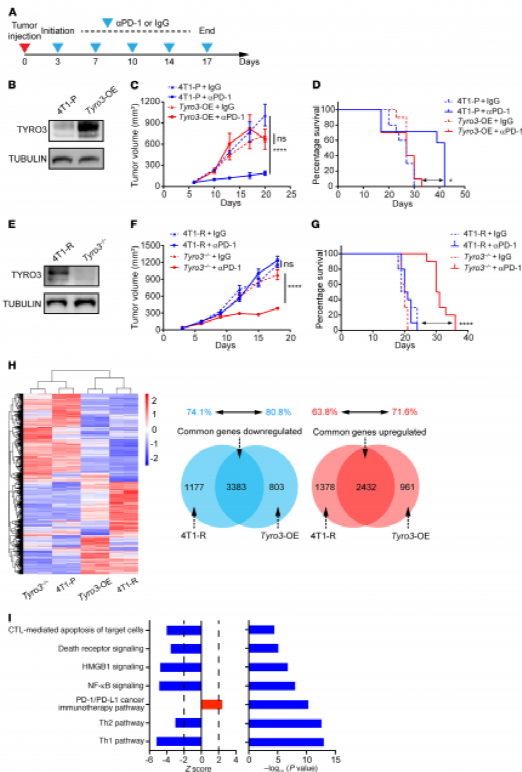
接下来,文章比较了小鼠模型中TYRO3过表达(Tyro3-OE)和4T1-P对抗mPD-1治疗的反应。抗mPD-1治疗可显著降低4T1-P小鼠肿瘤的发生率,但对Tyro3-OE没有。说明,Tyro3的过度表达促进了这些肿瘤的抵抗性(Fig2.B-D)。
而在Tyro3-/-组中,抗mPD-1治疗的小鼠比4T1-R肿瘤存活时间更长(Fig2.E-G),也说明Tyro3在抗mPD-1治疗抗性中发挥了重要作用。
为了更好地了解TYRO3在抗PD-1耐药中的作用,对4T1-P、Tyro3-OE、4T1-R和Tyro3-/-细胞RNA进行了全转录组分析:Tyro3-OE和4T1-R之间的转录组变化高度相似。
在287例黑色素瘤患者生物通路分析(Fig2.I),TYRO3在抗PD-1耐药性中发挥作用,TYRO3有利于抗炎性肿瘤微环境(TME)。
三、TYRO3通过抑制铁死亡、促进原肿瘤TME来诱导对抗PD-1治疗的抗性
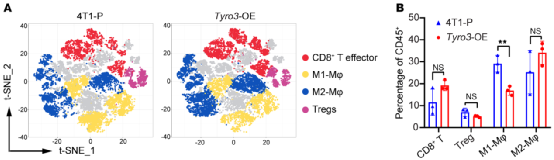
通过飞行时间质谱(CyTOF)和表图聚类分析Tyro3-OE和4T1-P免疫特征的总体变化:Tyro3-OE肿瘤中,M1/M2的比率的降低(Fig3.B);表明,TYRO3促进了M1-M2巨噬细胞的极化。
