

增加透明细胞癌对铁死亡敏感——文献解读
 2021-09-13 13:50:36
2021-09-13 13:50:36
来源/作者:普拉特泽生物-医学整体课题外包
透明细胞癌(CCC),以组织学分析中肿瘤细胞中的透明细胞质为标志,是肾恶性肿瘤中最常见和转移性形式,也是卵巢中最具治疗耐药性的一种。尽管CCC的发生率很低,但是它也来自其他广泛的组织,包括子宫颈,甲状腺,肝脏和胰腺。CCC患者的治疗呈现预后不良和广泛耐药性。
不同类型的细胞对铁死亡的敏感度有很大差异。铁死亡在晚期不能手术,或对传统治疗有耐受的的肿瘤患者的临床治疗中具有较大的研究价值。
下面我们就来介绍一篇研究“增加透明细胞癌对铁死亡敏感”的文章。
2019年,NATURE COMMUNICATIONS发表了一篇研究(IF:11.88),文章主要的研究结论是:
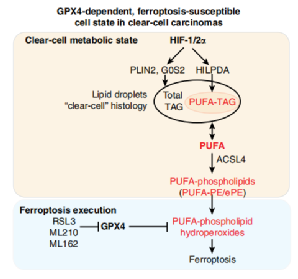
HIF-2α通过激活缺氧诱导的脂滴相关蛋白表达,抑制GPX4表达,从而增加透明细胞癌对铁死亡的敏感性。
“你是不是看完文献解读的开头就觉得困了”
在分析文献前,我们先来了解一下这些概念:
名词释义
铁死亡:一种由铁催化、多不饱和脂肪酸的过度氧化介导的调节性坏死。
HIF-2α:缺氧可溶性因子(HIF)通路,在肾脏CCCs中,HIF-2α通过激活低氧诱导脂滴相关蛋白(HILPDA)的表达,选择性地富集含有多不饱和脂肪酰基侧链的脂质,并诱导铁死亡影响的细胞状态。
EPAS1:编码HIF-2α,EP300,FOSL1,CITED1以及ARNT(编码HIF-1β)的基因
CCCs:透明细胞癌是一组高度侵袭性恶性肿瘤,通常起源于肾脏和卵巢。
ccRCC:透明细胞肾细胞癌
OCCC:卵巢(CCC)细胞系
RSL3、ML210和ML162:三种GPX4(谷胱甘肽过氧化物酶)抑制剂
ferrostatin-1(Fer-1):铁死亡抑制剂
liproxstatin-1(Lip-1):铁死亡抑制剂
Erastin:铁死亡激活剂
L-buthionine-S:一种有效而特异性的α-谷氨酰半胱氨酸合成酶抑制剂
TAG:triacylglycerols-三酰甘油
PUFA:多不饱和脂肪酰基
PEs:磷脂酰乙醇胺
ePEs:缩醛磷脂磷脂酰乙醇胺
癌症治疗反应门户网站(CTRP):筛药敏数据库
AUC指药时曲线下面积,是药动学参数:血药浓度曲线对时间轴所包围的面积。该参数是评价药物吸收程度的重要指标,反映药物在体内的暴露特性。由于药动学研究中血药浓度只能观察至某时间点t,因此AUC有两种表示方式: AUC(0-t)和AUC(0-∞),前者根据梯形面积法得到,后者计算式: AUC(0-∞) = AUC(0-t) + 末端点浓度/末端消除速率。
CRISPR-高通量筛选技术(CRISPR screening)(推荐配合单细胞测序一同了解)
简单了解一下CRISPR screening。有pooled screening、arrayed screening,两种。pooled screening,就是利用慢病毒载体进行,慢病毒载体可以整合到细胞基因组里而每个sgRNA的序列不同。这样就可以把整个基因组的gRNA或者是感兴趣的一些基因sgRNA混合在一起感染细胞,通过控制MOI可以保证一个细胞里只有一个sgRNA copy。然后就可以建库测序等。
目前共有基于3种不同 CRISPR 系统的高通量筛选平台,其构建的方式大致包括筛选文库的构建、目的细胞的感染、收集具有特定筛选表型的细胞、结合二代测序手段分析全基因组信息、获得富集sgRNA所对应的候选基因。
脂质代谢:哺乳动物细胞中,磷脂主要包括磷脂酸 (PA),磷脂酰胆碱 (PC),磷脂酰乙醇胺 (PE),磷脂酰肌醇 (PI), 甘油磷脂酰甘 油 (PG)以及磷脂酰丝氨酸 (PS)。
多不饱和脂肪酸(PUFA)是发生铁死亡的必要条件,因为PUFA易受脂质过氧化作用,游离PUFA是合成脂质信号传导介质的底物,但是必须要被酯化为膜磷脂(双分子层膜,磷脂酰乙醇胺)并进行氧化才能转化为有效信号。因此,游离PUFA的丰富和位置决定了细胞中脂质的受过氧化程度和铁死亡发生的可能性。脂质组学研究表明,包含花生四烯酸(C20:4)或其延伸产物肾上腺酸(C22:4)的磷脂酰乙醇胺(PEs)是关键的磷脂,它们会发生氧化并促使细胞发生铁死亡。这些PUFA的辅酶A衍生物的形成以及它们插入磷脂(PUFA-PEs)中对于产生铁死亡信号是必需的。

下面我们来一起看下这篇文章的整体思路和,十分枯燥但有用的结果解析:
整体思路
透明细胞癌中GPX4依赖的铁死亡敏感细胞状态
Results
PART1:GPX4抑制剂对CCC细胞有很高的的选择性
通过查询数据库发现谷胱甘肽过氧化物酶4(GPX4)抑制剂,表现出最高的选择性和杀伤CCC细胞,以及细胞肾细胞癌(ccRCC)对GPX4缺失非常敏感。后通过GPX4抑制剂处理,与铁死亡抑制剂和脂质检测确认了铁死亡是其主要的死亡方式,并建立GPX4缺失细胞系进行后续研究,同时发现GPX4缺失也会影响细胞生长,与抑制剂处理结果相符。
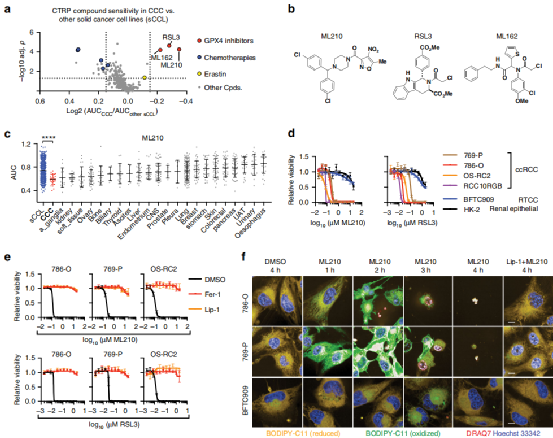
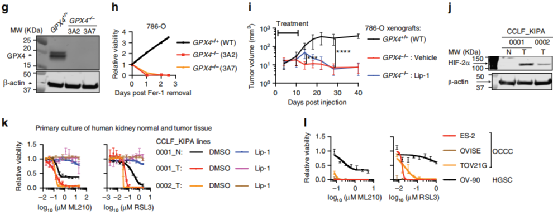
Fig1. (a-d)查询数据库发现谷胱甘肽过氧化物酶4(GPX4)抑制剂对CCC细胞表现出最高的选择性和杀伤性,并发现肾细胞癌(ccRCC)对GPX4缺失非常敏感。三种GPX4抑制剂RSL3、ML210和ML162,可以有效抑制CCC细胞增殖。并且CCC细胞中GPX4抑制剂的敏感性要强于任何特定实体瘤谱系的敏感性。(e-f)在加入铁死亡抑制剂后阻止了GPX4抑制剂引起的死亡,同时发现ML210处理诱导了ccRCC细胞中脂质自由基的快速积累,从而证实了铁死亡是主要途径。(g-h)建立与验证GPX4缺失细胞系,以及加入铁死亡抑制剂后抑制了细胞死亡。(J-I)患者来源的原代ccRCC细胞系中HIF-2a表达缺失,且抑制铁死亡后减少细胞死亡。
