

细胞彗星实验原理与详细实验步骤——彗星实验外包
 2022-03-15 11:55:08
2022-03-15 11:55:08
来源/作者:普拉特泽-生物医学整体课题外包平台
细胞的彗星实验原理与详细实验步骤由普拉特泽生物旗下的科研培训品牌《春风学院》与细胞实验中心联合总结分享,根据细胞实验中心承接的上千例彗星实验案例汇聚而来,如果您有彗星实验外包或其他细胞实验的外包需求,欢迎您联系我们的客服人员哦~
细胞的彗星实验背景:
分子水平的DNA 损伤检测方法之一。除此之外,还有wb和QPCR检测。3个检测手段各自依据原理不同。
WB在于检测目标蛋白的存在来验证DNA 的损伤;QPCR则通过检测DNA损伤特异基因的表达来说明DNA损伤情况,而彗星实验是基于单细胞凝胶电泳技术,鉴于已损伤DNA相对完整DNA的实验结果会有明显的拖带现象,类似于彗星的拖尾,所以被形象的称为彗星实验(单细胞凝胶电泳)。
细胞的彗星实验原理:
当各种内外源DNA损伤因子诱发细胞DNA链断裂时,DNA的双螺旋结构受到破坏,在细胞裂解液作用下,细胞膜、核膜等膜结构受到破坏,细胞内的蛋白质、RNA以及其它成分均扩散到细胞裂解液中,而核DNA由于分子量太大只能留在原位。在中性条件时,DNA片段可进入凝胶发生迁移,而在碱处理和碱性电解质的作用下,DNA发生解螺旋,损伤的DNA断链及片段被释放出来,由于这些DNA的分子量很小,所以在电泳过程中会离开核DNA向阳极移动,形成彗星状的图像,而未损伤的DNA部分保持球形。DNA受损越严重,产生的断片越多并且片段越小,电泳时迁移的DNA量也就越大,迁移距离越长,荧光显微镜下可观察到尾长增加、尾部荧光强度增强。在一定条件下,DNA迁移距离(彗星尾长)和DNA含量(荧光强度)分布与DNA损伤程度呈线性相关,因此,尾矩(尾部DNA的含量与尾长的乘积)成为定量测定单个细胞DNA损伤程度的主要依据。
造成DNA损伤的因素:
ROS X-射线 、紫外线 、抗肿瘤药。

正常DNA
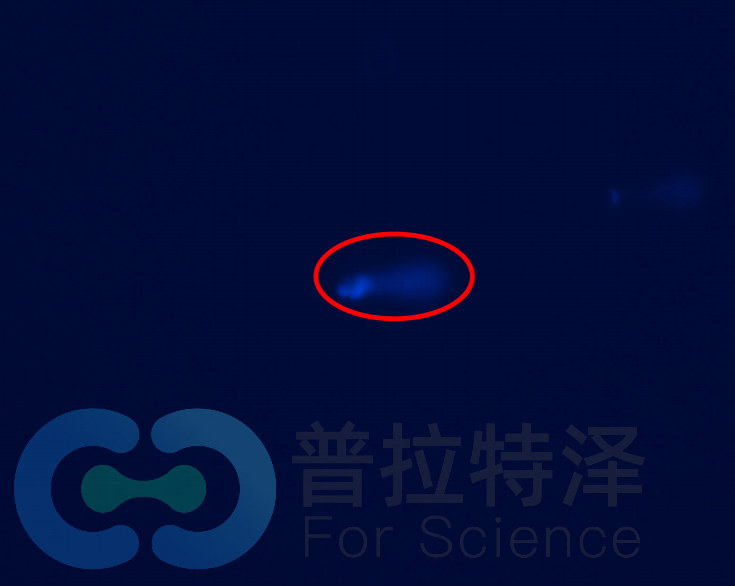
紫外线照射后的DNA
彗星实验步骤:
(1)彗星实验胶板的制备
① 第一层胶的制备:将已预热56℃的80uL 0.5%正常熔点琼脂糖NMA(溶于无Ca2+,Mg2+的磷酸缓冲液PBS)滴到同样预热的载玻片的磨砂面,迅速盖上干净的盖玻片,4℃放置10min使其凝固。
② 第二层胶的制备:取10μl含1000个细胞的PBS和75uL 0.5%低熔点琼脂糖LMA(溶于无Ca2+,Mg2+的磷酸缓冲液PBS)在37℃混匀,然后轻轻揭去盖玻片,将含细胞的LMA滴到第一层胶板上,立即盖上干净的盖玻片,4℃ 放置10 min使其凝固。
③ 第三层胶的制备:最后在凝固的LMA层上滴加85 uL预热37 ℃ 的0.5% LMA,盖上盖玻片,使其凝固。第一层胶的主要目的是使第二层平整和附着紧密,第三层胶的目的是对第二层细胞起保护作用。
(2)彗星实验待测细胞裂解,移去盖玻片,将载玻片浸入新配置的细胞裂解液中至少裂解1h(在放第一片开始计时,再以同样的顺序取出,确保每张片子裂解时间相同)。此步骤的目的是溶解细胞膜及核膜,除去蛋白质、RNA等,仅存留核骨架。
(3)DNA碱解旋 细胞裂解后,取出载玻片,用PBS冲洗2次,以去掉载玻片表面高浓度的盐,然后将载玻片置于水平电泳槽中,倒入新配置的碱性电泳缓冲液,约覆过胶面0.25cm。碱解旋20 min,以便使DNA在碱性条件下解螺旋形成单链DNA,使DNA断链,在电泳场中易于迁移。
(4)单细胞电泳 在25v、300mA条件下电泳20 min。
(5)中和与染色 电泳完毕后,将载玻片取出,滤纸吸干电泳缓冲液,用Tris-HCl(pH7.5)中和15 min。然后每片载玻片上滴加50μl 30μg/mL的溴化乙锭(EB)溶液,避光操作,盖上盖玻片,避光染色20 min,即可观察。
(6)细胞彗星实验的结果观察与实验数据处理。

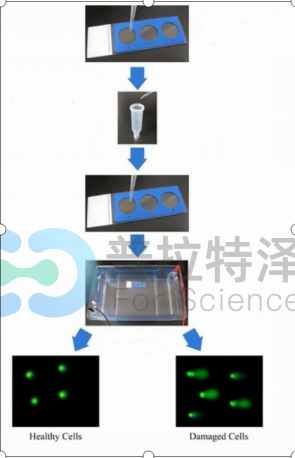
彗星实验详细步骤
