

细胞转染的常用方法及案例
 2021-05-27 16:26:52
2021-05-27 16:26:52
来源/作者:普拉特泽生物-医学整体课题外包
细胞转染是指将外源分子(如DNA,RNA等)导入(真核) 细胞的实验技术之一。随着分子生物学和细胞生物学研究的不断发展,转染已经成为研究和控制真核细胞基因功能的常规工具。
除转染以外,关于基因片段转移的方法还有很多,像转化,转导,感染等,为了避免混淆,更好地区分这些概念,我们做了一个小总结。
转染(Transfection):指重组质粒载体或游离核苷酸在脂质体等介导下进入真核细胞。
转化(Transformation):指含外源基因的重组质粒(载体)将外源基因直接导入原核细胞(如细菌),使之获得新的遗传特性。
转导(Transduction):指通过重组病毒载体将外源基因导入真核细胞或原核细胞,从而引起的基因重组现象。
感染(Infecion):重组病毒载体入侵受体细胞导致的病理生理过程。
言归正传,还是要说到我们今天的主角——细胞转染。
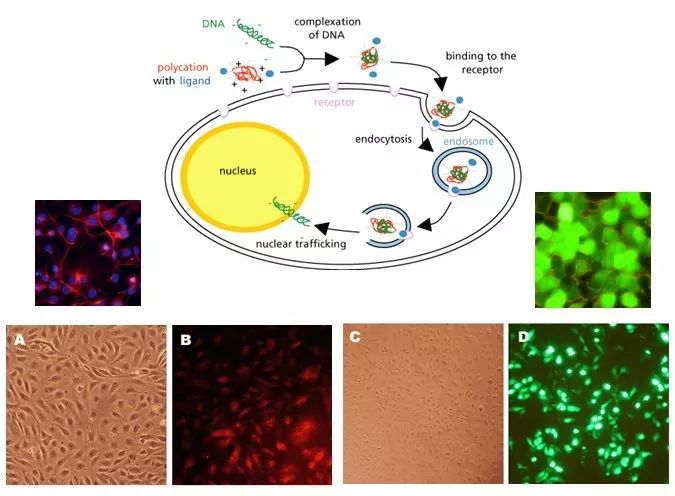
细胞转染可分为瞬时转染和稳定转染,瞬时转染指外源DNA/RNA不整合到宿主染色体中,通常只持续几天,在转染后24-72小时内分析结果,多用于启动子和其他调控元件的分析。稳定转染指外缘DNA既可以整合到宿主染色体中。通常需要通过一些选择性标记来筛选以得到稳定转染的细胞系。根据转染方法可以分为物理介导、化学介导和生物介导。
我们常用的细胞转染方法有电穿孔法、显微注射、基因枪、脂质体转染,磷酸钙共沉淀法、原生质体转染、病毒介导的转染。
不同的转染方法有不同的特点,在转染实验时根据实验室的具体条件(包括已有设备)确定最佳转染方法,我们为大家总结了一些常用转染方法的特点及适用细胞范围:
显微注射:最精确,成本最高;
磷酸钙法:最朴实,成本最低;
脂质体/聚合物法:最常规,工具细胞最佳选择,但不一定所有细胞都适合;
电转法:非工具细胞最佳选择,常用于难转染/转染效率低的细胞系或者建立筛选细胞株,关键是要有仪器-点转移。
细胞转染做的好不好除了受转染方法的影响外,还有很多别的影响因素,像细胞状态和密度、培养基、载体大小等多方面因素都会影响到我们最后的转染效率,所以细胞转染是一个常见但是却并不简单的实验,尽管如此,我们还是要努力追求最理想的细胞转染原则——转染效率高、细胞毒性小、重复性好、安全、方法简单、省时、经济。因此,我们技术部的老师们特别提醒大家留心以下注意事项:
1、转染前细胞必须处于良好的生长状态,不建议为了赶实验周期而在细胞生长状态不稳定或较差的时候强行转染。(磨刀不误砍柴工,调整好状态,转染效率更佳哦!)
2、建议做好转染预实验,摸索最合适于细胞的转染手段及转染体系,尤其原代细胞、悬浮细胞、淋巴细胞等,不建议所有细胞一个转染操作标准;同时设置工具细胞(293T)转染对照组。(具体情况具体分析,不要想着一招鲜吃遍天哦!)
3、不同目的/片段类型推荐使用不同的转染试剂,转染试剂的选择要慎重。(别买到水货假货啦!~)
4、质粒纯度:A260/A280比值(1.7-1.9),越近1.8越好;
5、质粒浓度:细胞转染的质粒浓度不低于500μg/μL,病毒包装的质粒浓度不低于0.8μg/μL;
6、转染质粒必须用去内毒素试剂盒去除内毒素;
7、病毒包装的质粒建议采用非过滤柱型大提试剂盒进行质粒的提取;
8、建议使用非血清型转染培养基;
9、转染试剂及转染复合物使用后立即盖好盖子,避免长时间暴露在空气中,影响转染效率;
10、不要使用冻结的或储存温度低于4℃的脂质体试剂;
简单介绍过后大家可能会迫不及待地想知道,细胞转染到底是怎么做的呢,接下来介绍常见的转染方法。
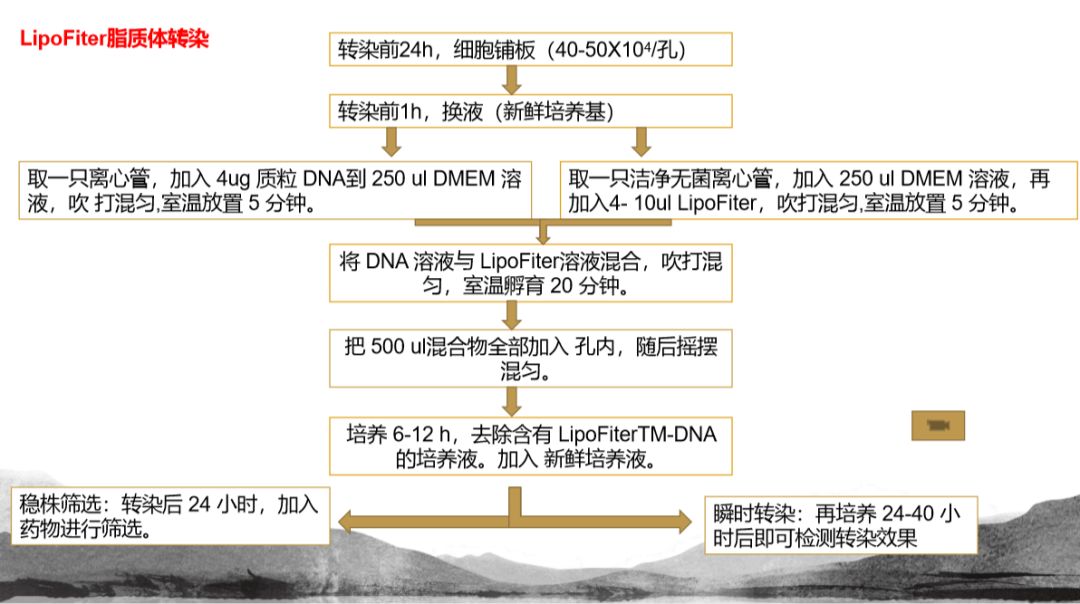
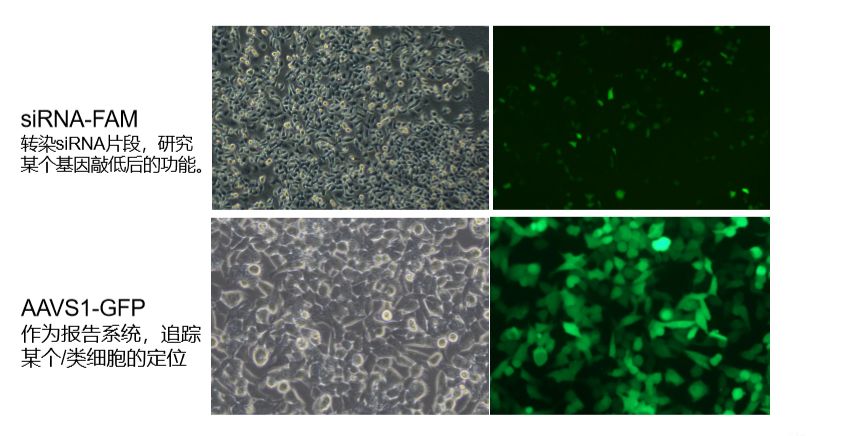
接下来就是欣赏我们经典案例的时候了:
最后的最后是给客户爸爸们的小小的建议,非常感谢各位老师们选择我们实验室,为了不辜负老师们的信任,为了得到真实又靠谱的检测结果,也为了和平与爱,我们有一些小小的要求:
① 提供质粒的时候,最好同时提供一下质粒图谱,以便技术部的老师们查看筛选标记及荧光标签蛋白,做转染时也好加做一个质粒阳性转染对照哦。
② 由于质粒的浓度和纯度会影响转染的效率,所以老师们提供的质粒在邮寄给我们前,最好也做下质粒的浓度/纯度的测定。
③ 如果需要用到老师们自己提供的试剂时,邮寄前请先跟我们技术支持联系哦,按照样品提供要求要求进行寄送。
这些都是避免您珍贵的样本被浪费,或在运输途中造成损失的避免方法哦~!
