

细胞铁死亡的机制
 2024-11-25 13:31:55
2024-11-25 13:31:55
来源/作者:普拉特泽-生物医学整体课题外包平台
细胞铁死亡的机制介绍由普拉特泽生物整体课题平台总结分享,细胞铁死亡(Ferroptosis)是一种新型的、铁依赖性的程序性细胞死亡方式,近年来在生物学和医学研究领域中引起了广泛关注。
普拉特泽生物为广大科研实验人员提供细胞铁死亡外包实验服务,先一起来学习学习细胞铁死亡的机制吧~
铁死亡的主要特征是铁离子依赖的脂质过氧化物的积累,这一过程与多种疾病的发生和发展密切相关,如神经退行性疾病、肿瘤、动脉硬化、糖尿病和急性肾损伤等。
(一)铁死亡的主要机制
铁死亡的发生机制复杂,涉及多个生物分子的相互作用和调控网络。以下是铁死亡的主要机制:
『铁代谢紊乱』:
血液循环中的Fe³⁺与转铁蛋白结合并运输到细胞中,通过转铁蛋白受体1进入细胞后被还原为Fe²⁺,并释放到胞质的不稳定铁池(LIP)中。
Fe²⁺具有不稳定性和高反应活性,通过芬顿反应产生羟自由基,这些自由基直接与细胞膜和质膜中的多不饱和脂肪酸反应,产生大量脂质活性氧(ROS),导致细胞死亡。
『氨基酸抗氧化系统失衡』:
生理条件下,system XC-由溶质转运家族7A11(SLC7A11)和SLC3A2组成,将胱氨酸运输至细胞内并被还原为半胱氨酸,用于合成细胞内主要的抗氧化剂谷胱甘肽(GSH)。
GSH是谷胱甘肽过氧化物酶4(GPX4)的一个必要辅因子,可将还原型GSH转化为氧化型GSH,同时还原脂质过氧化物,从而减轻氧化应激损伤。因此,system XC-和GPX4是铁死亡氨基酸代谢中的重要调控靶点。
『脂质过氧化物集聚』:
脂质过氧化物集聚是铁死亡的核心机制。铁死亡过程中,多不饱和脂肪酸如花生四烯酸(AA)或肾上腺酸(AdA)是最容易发生氧化反应的脂质。
这些脂质受三种合成酶调控:乙酰辅酶A合成酶长链家族4(ACSL4)将AA或AdA催化为相应的辅酶A,然后溶血卵磷脂酰基转移酶3(LPCAT3)将其酯化为磷脂酰乙醇胺(PEs),最后经脂肪氧合酶氧化为脂质过氧化物。
(二)铁死亡的形态学和生化特征
▲铁死亡在形态学和生化特征上表现出独特的标志:
形态学特征:铁死亡会导致细胞线粒体萎缩变小,嵴减少甚至消失,膜密度增高,细胞膜断裂和出泡,细胞核形态变化不明显。
生化特征:铁死亡表现为脂质过氧化增高,ROS升高,铁离子聚集,以及GPX4活性下降。
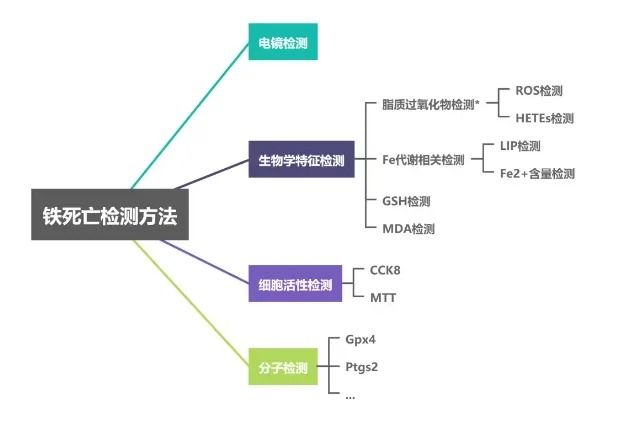
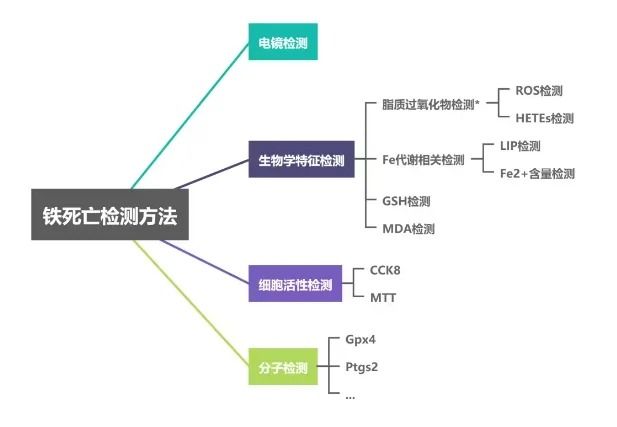
铁死亡的检测方法
▲为了验证铁死亡的发生,可以通过多种检测方法进行确认:
○形态学检测:观察细胞线粒体的形态变化,如线粒体变小、膜密度增加等。
○脂质过氧化物检测:使用特异性荧光探针(如DCHF-DA)进行半定量分析,或通过ELISA和TBAR检测脂质ROS下游副产物(如4-HNE蛋白质加合物和MDA)。
○铁离子水平检测:使用比色反应检测铁离子水平,如使用菲洛嗪等化合物。
○线粒体膜电位检测:使用探针如JC-1和JC-10检测线粒体膜电位的变化。
○分子水平检测:通过Western Blot和PCR等方法检测细胞内相关因子的变化,如GPX4、GSH、转铁蛋白和转铁蛋白受体1等。

(三)铁死亡的研究意义
铁死亡作为一种新型的细胞死亡方式,在疾病的发生和发展中起着重要作用。通过揭示铁死亡的详细调控机制,可以开发新的铁死亡特异性标志物检测技术,为疾病的治疗提供新的思路和策略。例如,在肿瘤治疗中,通过激活或抑制铁死亡来干预肿瘤的发展,已成为一种潜在的治疗手段。


综上所述,铁死亡是一种复杂的细胞死亡方式,涉及铁代谢紊乱、氨基酸抗氧化系统失衡和脂质过氧化物集聚等多个机制。通过深入研究铁死亡的机制,可以为相关疾病的治疗提供新的科学依据和治疗方法。
如果你总是在做实验时总会遇上这样那样的问题需要帮助时,请记得在细胞铁死亡研究中遇到技术问题可添加技术微信:18570028002!同时还可以加入实验技术交流一起探讨生物医学科研相关的问题
我司还提供实验外包服务或实验培训。

