

染色质免疫共沉淀(CHIP)实验原理详解
 2024-08-16 11:12:20
2024-08-16 11:12:20
来源/作者:普拉特泽-生物医学整体课题外包平台
染色质免疫共沉淀(Chromatin Immunoprecipitation,简称ChIP)实验是一种重要的分子生物学技术,用于研究细胞内蛋白质与DNA之间的相互作用。该技术的核心原理是通过特异性抗体识别并结合目标蛋白(如转录因子),从而共沉淀出与其互作的DNA片段,进而分析这些DNA片段的序列及其与蛋白质的结合情况。ChIP实验为研究基因表达调控、转录因子功能及表观遗传机制提供了重要的实验依据。染色质免疫共沉淀(CHIP)实验介绍由普拉特泽生物分子检测平台总结分享,分子检测平台为广大科研实验人员提供CHIP实验外包服务,先一起来学习学习什么是CHIP实验吧!
实验原理
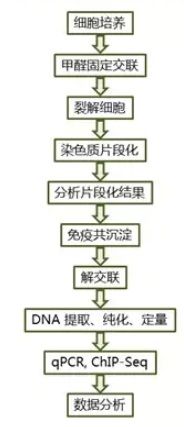
ChIP实验基于特异性抗体识别目标蛋白与DNA形成的复合物原理。实验流程主要包括以下几个步骤:
①组织交联: 使用甲醛或其他交联剂固定细胞内的蛋白质与DNA之间的相互作用,使它们保持结合状态,便于后续实验操作。交联时间和甲醛浓度的选择对实验结果有重要影响,需根据不同的细胞类型和目标蛋白进行优化。
②胞核制备与染色质碎裂: 细胞裂解后,利用超声波或其他酶处理将染色质碎裂成适当大小的片段(通常为200-500bp)。这一步是实验成功的关键,因为DNA片段的大小分布直接影响抗体的结合效率和实验结果的可靠性。
③抗体结合与免疫沉淀: 选择高亲和力和特异性的抗体,通过抗原-抗体反应结合目标蛋白-DNA复合物。然后,利用磁珠或蛋白A/G柱进行免疫沉淀,富集目标蛋白-DNA复合物。这一步骤中,抗体和磁珠的比例、孵育时间及条件对实验结果具有显著影响。
④洗涤与DNA回收: 通过一系列洗涤步骤去除非特异性结合的蛋白质或DNA,确保最终获得的DNA纯净且特异性高。随后,使用ChIP洗脱缓冲液和蛋白酶K处理,通过热逆转交联,从复合物中释放出DNA。
⑤qPCR分析: 通过设计特异性引物,针对目标DNA序列进行qPCR分析,定量检测目标序列的富集情况。通过与内参(如INPUT样品)的比较,可定量分析蛋白质与特定DNA序列的结合强度。

实验步骤
①交联: 在活细胞状态下加入甲醛,使细胞内的蛋白质和DNA交联。交联时间通常为5分钟到1小时,需根据细胞类型和目标蛋白进行调整。
②染色质碎裂: 利用超声波或其他方法将交联后的染色质碎裂成适当大小的片段。超声条件需精确控制,以保证DNA片段大小分布的一致性。
③免疫沉淀: 将碎裂后的染色质与特异性抗体孵育,形成DNA-蛋白质-抗体复合物。随后,利用磁珠或蛋白A/G柱进行免疫沉淀,富集目标蛋白-DNA复合物。
④洗涤与DNA回收: 通过多次洗涤步骤去除非特异性结合的蛋白质和DNA,然后逆转交联并回收纯化的DNA。
⑤qPCR分析: 设计特异性引物,通过qPCR检测目标DNA序列的富集情况,定量分析蛋白质与DNA的结合强度。
实验注意事项
交联时间和甲醛浓度的选择: 交联时间过长或过短都会影响实验结果,需根据细胞类型和目标蛋白进行优化。
㈠染色质碎裂条件: 超声碎裂条件需精确控制,以保证DNA片段大小分布的一致性。同时,避免在超声过程中产生泡沫或升温,以免影响蛋白质活性。
㈡抗体选择: 选择高亲和力和特异性的抗体是实验成功的关键。同时,需考虑抗体与DNA的非特异性结合可能性,设置合适的对照实验。
㈢洗涤步骤: 洗涤步骤是去除非特异性结合的关键,需根据实验需求调整洗涤液的种类和次数,以确保背景信号最小化。
㈣qPCR分析: 选择合适的内参和特异性引物,确保qPCR分析的准确性和可靠性。同时,需考虑实验的技术变异,包括PCR扩增效率的变异和样本处理过程中的损失。

结论
染色质免疫共沉淀(ChIP)实验是研究蛋白质与DNA相互作用的重要技术。通过精确的实验设计、严格的样品处理和详细的数据分析,ChIP实验不仅可以揭示转录因子的DNA结合位点,还能深入理解基因表达的调控机制。随着高通量测序技术的发展,ChIP实验的应用范围将进一步扩展,为基因调控研究及相关。
如果想知道更多的关于CHIP实验的相关实验报告和知识点,以及专属研究方法,也可以联系我们:18570028002或微信 pulateze666会把这些资料发送给大家哦。领域提供更多的科学见解。

