

【精品导读】解锁核孔蛋白NUP210的力量:通过破坏肿瘤细胞的力学响应,抑制转移
 2023-10-08 13:31:15
2023-10-08 13:31:15
来源/作者:普拉特泽-生物医学整体课题外包平台
——妈耶~这篇文章的图片太漂亮了好想拥有!

下面请跟随小编,一起了解这篇文章的新发现吧!
背景
癌症通常会从某一种癌扩散至另一种癌,这与癌细胞的转移有关。结果是导致疾病的恶化和治疗的困难。那么该如何解决这一难题?
本文作者从抑制癌症转移出发,研究并发现了核孔蛋白NUP210可以作为抑制癌症转移的关键靶点。这一发现提供了一种新的抑制癌症转移的策略,即通过干扰核孔蛋白NUP210来改变肿瘤细胞的力学特性,抑制转移。
Nuclear pore protein NUP210 depletion suppresses metastasis through heterochromatin-mediated disruption of tumor cell mechanical response
译:核孔蛋白NUP210的缺失通过异染色质介导的肿瘤细胞机械反应破坏抑制乳腺肿瘤细胞转移
Nat Commun (IF: 14.92; Q1). 2021 Dec 13;12(1):7216.
doi: 10.1038/s41467-021-27451-w.
https://pubmed.ncbi.nlm.nih.gov/34903738/
上结果咯~咱挑重要的讲,想看详细的戳上面的链接
一、聚焦乳腺癌数据库筛选出的NUP210转移易感基因
首先,作者通过MMTV-PyMT模型(乳腺癌促癌基因模型)发现了52个潜在的转移易感基因(1a),同时在之前的研究基础上,发现NUP210基因,因此在4T1细胞系中做RNA-seq研究,结果显示NUP210转移比非变异细胞高(1b)。
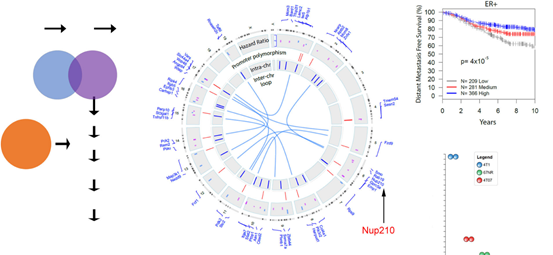
图1
二、NUP210的表达和敲降会改变肿瘤的转移能力
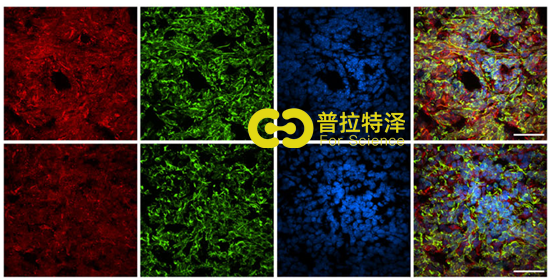
在小鼠模型的基础上,通过在METAB-RIC(乳腺癌国际数据库)中进行,同时进行乳腺癌组织微阵列,结果发现有无乳腺癌细胞中差异不显著(2b),而NUP210存在蛋白异质性(2a),同时发现淋巴结转移的NUP210水平明显(2c-d),内脏转移的NUP210比非内脏高(2e)。
NUP210的敲降会使得三类小鼠的肺转移下降,(3a-b),而过表达后肺转移是增加的(3c-d),因为三类小鼠的重量无显著差异,这一过程排除了肿瘤细胞自身增殖带来的影响。
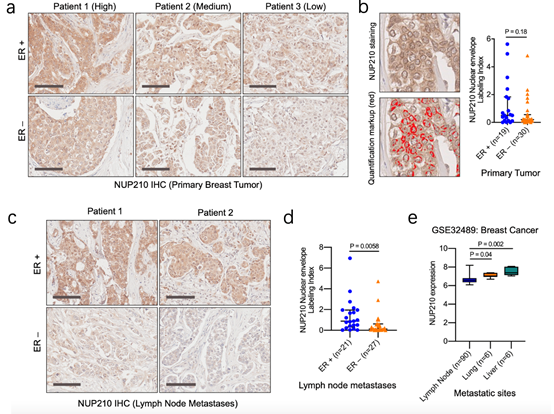
图2
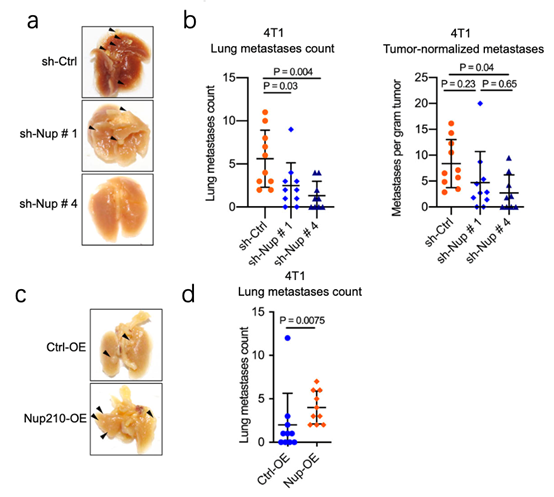
图3
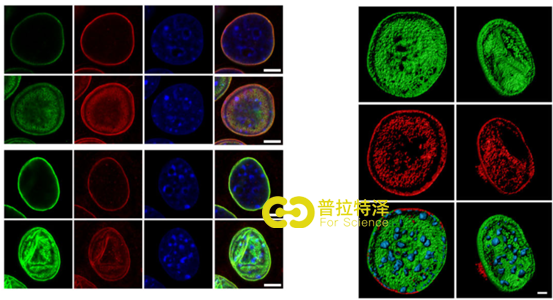
三、NUP210通过组蛋白H3.1/3.2连接到核外围
为了探究NUP210相互关联的蛋白质,利用Co-IP-seq实验,发现有作用的是组蛋白H3.1(4a),利用H3.1/3.2的抗体反向验证了这一相互作用关系,同时还发现该抗体还下拉了LaminB1,该蛋白是核层组成部分,这一结果表明了互作的关系发生核外围(4b)。基于此,免疫荧光的结果同样证实了H3.1/3.2和NUP210的核外围互作关系(4c-d)。而敲降NUP210进行的Co-IP实验结果显示,H3.1/3.2与LaminB1的关联下降(4e)。这些结果均表明:NUP210能够将H3.1/3.2束缚在核外围。
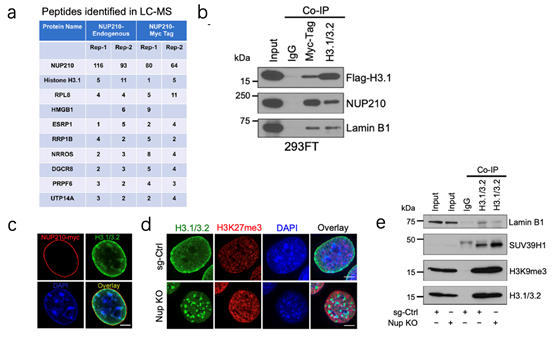
图4
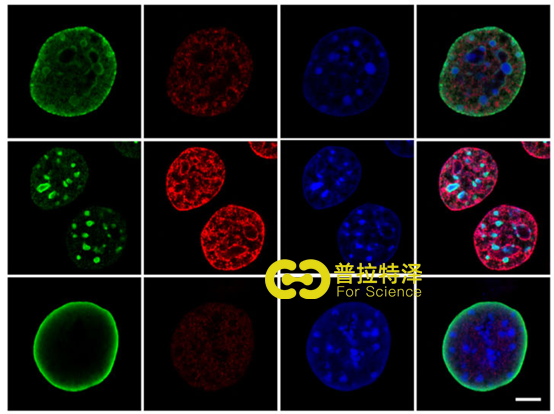
四、NUP210敲降细胞招募异染色质来减少细胞粘附/迁移
为了研究NUP210与H3.1/3.2的相互作用关系在转移细胞中的影响,通过敲降NUP210研究细胞的S期发现无持续变化(5a-b),这表明关联可能在转移细胞中具有不同的作用。通过进一步研究发现敲降NUP210后H3.1/3.2从核外围重新分布到核内的病灶状结构e核(4d,5c),这说明NUP210发挥转移作用机制可能是将H3.1/3.2束缚在核膜上。同时实验中还发现H3K27me3异染色质标记显著富集,3D重建结果显示,H3.1/3.2位于H3K27me3的外围,同时许多病灶也出现在富含染色质的核细胞外围(5c-d)。
为了明确NUP210与异染色质的关系,通过敲降NUP210进行活细胞成像,结果发现细胞核显著减小,同时增加了异染色(4e)。Co-IP的结果显示,H3.1/3.2与一些异染色质修饰酶如SUV39H1、EZH2的关联有所提高。总之,这些结果表明NUP210能招募异染色质修饰酶从而将H3.1/3.2限制在核外围。
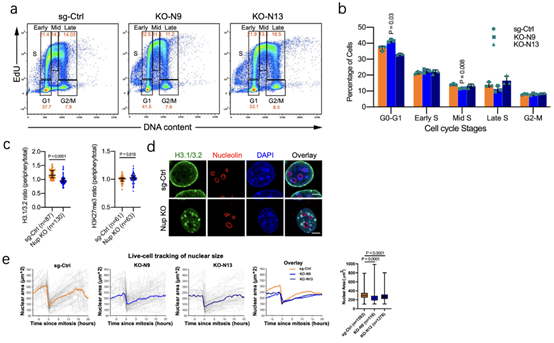
图5
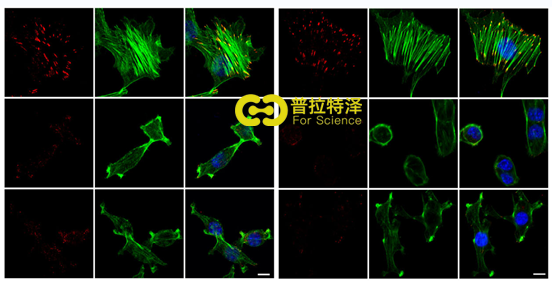
五、NUP210机械敏感,能影响癌细胞的肌球蛋白收缩性
NUP210敲降后除了能导致细胞出现较少的扩散(6a)外,还会降低粘附、肌动蛋白应力纤维(6b、c),其中肌动蛋白张力改变会介导机械反应,因此研究了NUP210在转移细胞中是否机械敏感,结果显示,许多NUP210调控基因对更高的细胞外基质(ECM)刚度条件更敏感(6d),在较高刚度下,细胞具有更强的扩散性(6e),NUP210敲降与癌细胞肌球蛋白收缩性降低有关。这一结果表明,NUP210是细胞外基质ECM刚度和成分传感器的一部分,显著影响肿瘤细胞的迁移和侵入能力。
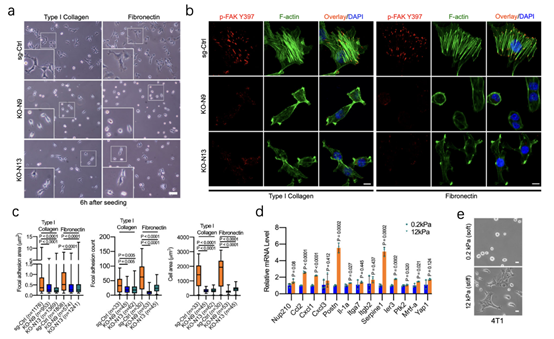
图6
六、NUP210作为LINC复合物相关蛋白,可调节机械敏感基因的表达
LINC是核骨架和细胞骨架的连接剂,可以进行机械转导。为了探究NUP210与LINC之间的互作关系,通过Co-IP实验发现,NUP210与 LINC复合蛋白SUN2存在相互作用(7a),而NUP210敲除后,SUN2扩散至整个细胞,核内分布显著增加(7b)。研究还发现了LaminA/C强度增加(7c,f),该蛋白的增加会增强核刚度,从而使异染色质介导的核大小减小。
通过Co-IP实验结果发现,H3.1/3.2与4T1细胞中的NUP210、BRD4-SF、SUN2、RRP1B蛋白复合物相关(7d),同时发现BRD4-SF能与细胞中的NUP210相互作用(7e)。通过添加BRD4-SF抑制剂JQ1,发现H3.1/3.2从核外围重新分布,且异染色质标记的H3K27me3增加(8a-b),活细胞成像显示降低核大小(8c),NUP210和依赖基因表达下降(8d)。这一结果表明NUP210与LINC蛋白复合物相关,同时还发现其介导与H3.1/3.2相关染色质的相互作用,以调节转移相关的基因表达。
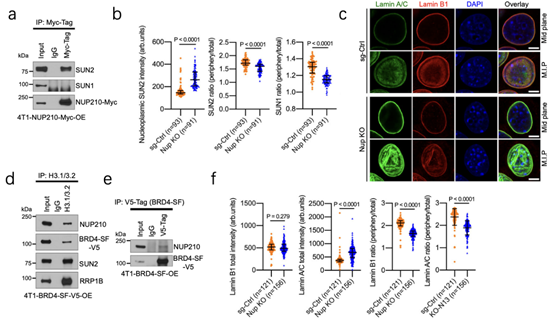
图7
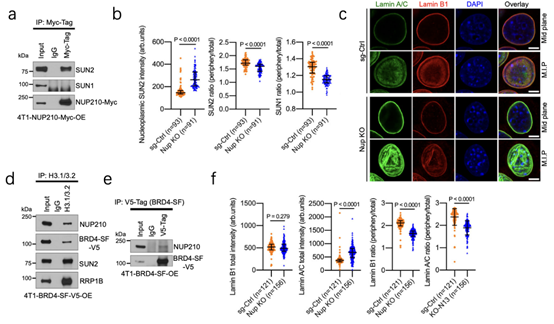
图8
结论
总的来说,通过与LINC复合蛋白和染色质的相互作用,本文确定了核孔体成分在调节机械敏感、原转移基因方面的运输独立作用,即通过NUP210—SUN1—SUN2—BRD4—SF—H3.1/3.2蛋白复合物这一过程激发局灶粘附、细胞迁移和转移所需的下游信号通路(下图)。然而,由于异染色质调节和肌动蛋白细胞骨架张力之间的潜在正反馈回路,我们无法具体排除NUP210损失的因果效应。需要进一步研究,以充分了解NUP210在调节细胞机械感神经方面的机制。这不仅为癌症治疗提供了新的思路,也为我们对细胞核孔的功能和癌症转移的机制有了更深入的了解。
想要本文中漂亮的图片吗?速速联系我们!TSA多色荧光染色剂激光共聚焦免费拍福利等着你来参与!详情请见公众以往推送!
https://mp.weixin.qq.com/s/clMpks3XE6ZQJbYyQgZnOQ
https://mp.weixin.qq.com/s/7CKhGlJfBEbF-5_fYerXOw
