上个月为大家分享了一篇《Nature Communications》中的单细胞文章,今天小编再给大家提供一个单细胞研究案例,对照两年内同水平文章内容深度变化,可以发现目前仅凭单细胞测序要想出高分文章已经不够了,需要增加研究深度及实用性,但从细胞层面来揭示和攻克疑难科学问题仍是未来研究的热门趋势,也是治疗疑难杂症的理论基础。本研究案例为多院校合作研究团队从细胞水平揭示了:睾丸支持细胞发育路径及其在非梗阻性无精子症(NOA)中的重要作用。为治疗男性不育问题带来了新的思路。
论文链接:110.1038/s41467-020-19414-4
非梗阻性无精子症(NOA)是男性不育的最严重的形式,发生在10-15%的不育男性中。然而,仅有少部分是由先天因素造成的,大部分是由未知原因引起,也被称为特发性NOA(iNOA),占70%以上,尽管通过手术后可以在iNOA患者中发现精子,但成功率极低。
精子发生取决于体细胞微环境的完全成熟,因此对NOA患者进行有效的病因分析和治疗,就需要充分了解体细胞微环境中细胞的变化情况。作者对10名不同年龄段的健康组和7名NOA患者组进行了8万个睾丸细胞的单细胞转录组测序,揭示了不同NOA支持细胞的病理变化和成熟障碍,还获得了Wnt信号通路调节正常和NOA支持细胞成熟的证据,为生精微环境的成熟和发病机制提供了深入的见解,也为临床NOA的诊断方法和治疗靶点提供了新的思路。
研究者从10名生精正常样本(婴儿到成年)和7名NOA患者共获得88723个睾丸细胞,每个细胞平均检测到2719个基因(图1a-c)。对正常不同年龄段与不同NOA患者睾丸细胞UAMP分析(图d-f)及细胞差异度分析(图1g),正常成人和三种NOA患者的支持细胞最为显著,表明NOA患者的体细胞微环境的变化主要发生在支持细胞中。因此睾丸支持细胞可能影响着NOA的发生。
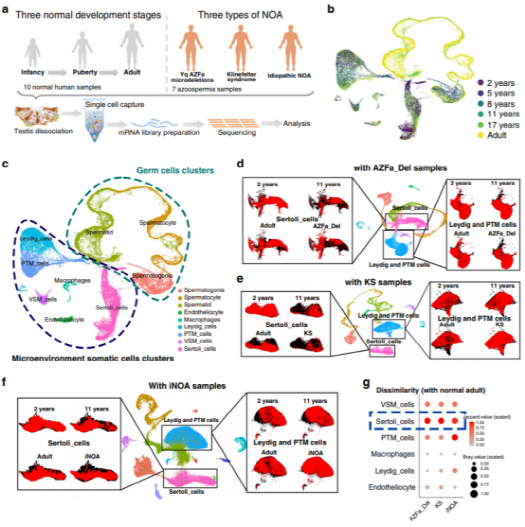
图1婴儿期至成年期和NOA患者的人类睾丸细胞的整体表达谱分析
研究者对10个生精正常供体的支持细胞进行重聚类和拟时序分析,睾丸支持细胞的增殖、能量代谢等表明支持细胞经历了3个不同的连续发育阶段(图2a-b)。随着年龄的增长,Stage_a占比逐渐降低,Stage_b占比逐渐增加,青春期时期Stage_c出现,在青春期后期发育至稳定状态(图2c)。通过差异基因分析(图2d)、功能富集分析(图2e)及免疫组化在蛋白层面的验证(图2f),还发现睾丸支持细胞的主要功能与生殖细胞及其代谢物清除有着密切联系。
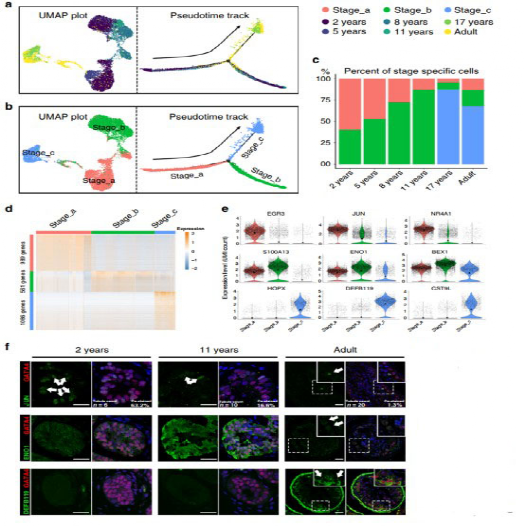
图2 支持细胞3个发育阶段的鉴定
通过IPA结果表明从Stage_a到Stage_b过程中细胞增殖相关信号被抑制,上皮细胞粘附分子连接的重塑信号被激活;从Stage_b到Stage_c过程中Wnt/β-连环蛋白信号被抑制,而生殖细胞-支持细胞连接信号等被激活(图3a-b),表明支持细胞的增殖发生在Stage_a,结构重塑发生在Stage_b,揭示了支持细胞成熟的调控网络。

图3 支持细胞3个发育阶段的推断信号通路
通过UMAP分析显示支持细胞可分为三个亚群,即cluster1-2(iNOA支持细胞组成)和cluster 3(健康成人支持细胞),且发现cluster1与的Stage_a相似,cluster2与的Stage_b相似(图4a-b)。通过IPA分析Wnt通路在cluster1-2中被激活,而正常支持细胞中Wnt细胞通路被抑制(图4c-d)。因此,推测Wnt通路的异常激活导致iNOA支持细胞的成熟缺陷。
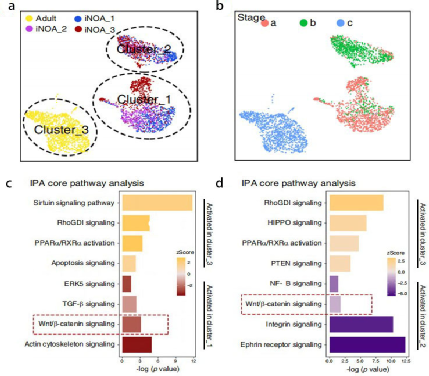
图4 iNOA支持细胞的异质性和成熟停滞
通过对来自iNOA病人和正常支持细胞进行了体外培养,并添加不同的Wnt信号通路抑制剂,结果发现抑制剂ICG显著降低了iNOA和正常支持细胞的增殖(图5a);通过探究不同处理的支持细胞对生殖细胞的影响发现ICG可促进生殖细胞的增殖(图5b-c)。因此,抑制Wnt途径可有效缓解iNOA支持细胞的成熟障碍并促进生殖细胞的正常功能。
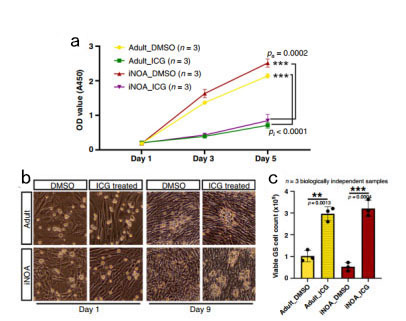
图5 抑制Wnt通路可体外诱导支持细胞的成熟
该研究通过分析不同年龄正常人类和NOA患者的单细胞转录组,不仅揭示了正常睾丸中主要细胞类型及其成熟过程,发现了支持细胞经历三个独立且连续的发育阶段(Stage_a、Stage_b和Stage_c),还通过比较主要类型NOA患者睾丸细胞的成熟障碍揭示了不同类型NOA的发病机制,还发现了抑制Wnt途径可有效缓解iNOA支持细胞的成熟障碍并促进生殖细胞的正常功能。为进一步研究睾丸支持细胞的发育提供了理论基础,为开发NOA的诊断和治疗方法铺平了道路。
单细胞测序指在单个细胞水平上进行基因组、转录组或表观组测序的技术,近几年单细胞测序技术取得飞速发展及瞩目成果,越来越多的高水平文章横空出世,在肿瘤、微生物、免疫学和神经科学等领域正在慢慢得到应用。普拉特泽生物已搭建全新单细胞多组学测序分析平台,拥有过硬的实验技术团队和丰富的项目经验可以为广大科研工作者和临床工作者提供更为优质的单细胞多组学服务,包括:单细胞转录组,单细胞转录组+V(D)免疫组联合分析,单细胞ATAC以及单细胞ATAC+mRNA联合分析。此外我们还提供利用Feature Barcoding的单细胞表面蛋白检测,及单细胞表面抗原特异性检测等服务。

流式检测|病理检测|动物模型|实验服务|分子操作|免疫相关检测
免费热线:400-691-6686
官网:http://www.uptbio.com


 2023-07-24 13:55:04
2023-07-24 13:55:04
