国自然热点文献乳酸化文献解读,本次分享的文献题目是:Lactylation of PKM2 Suppresses Inflammatory Metabolic Adaptation in Pro-inflammatory Macrophages,影响因子10.75分,发表在Bone Research杂志上,发表时间为2022年10月。
在自然伤口愈合过程中,巨噬细胞最初表现出促炎表型,这对杀死微生物至关重要,但会导致周围组织的广泛损伤;但过不久,巨噬细胞功能转变为修复表型,限制炎症反应并负责组织再生。抑制巨噬细胞从促炎表型向修复表型的转变会延迟伤口愈合。然而,其潜在的分子调控机制并不明确。代谢适应是巨噬细胞表型转变的前提和重要标志;促炎巨噬细胞表现出Warburg效应。有文献支持抑制糖酵解可以刺激腹腔巨噬细胞从促炎表型转变为修复表型。因此,干扰巨噬细胞的代谢谱可能是调节表型的关键。丙酮酸激酶M2 (PKM2)与Warburg效应关系密切。PKM2受到复杂的变构调控,指导其丙酮酸激酶活性,主要以单体或二聚体形式存在,其酶活性不如PKM1。促进PKM2丙酮酸激酶活性抑制Warburg效应和乳酸生成,这是一种被称为Warburg效应中的PKM2悖论的现象。近来研究发现了一种新的翻译后修饰:赖氨酸乳酸化且可被乳酸促进此过程的发生。虽然PKM2介导乳酸生成已证实,但乳酸和乳酸化是否调节PKM2丙酮酸激酶的活性或功能仍然很大程度上未知。基于以上背景,作者提出以下假说:乳酸是否会影响PKM2活性以及修饰PKM2,从而影响糖酵解,调控巨噬细胞的炎性-修复表型转变,最终影响伤口愈合?
那接下来看作者是如何一步一步来验证其猜想的。
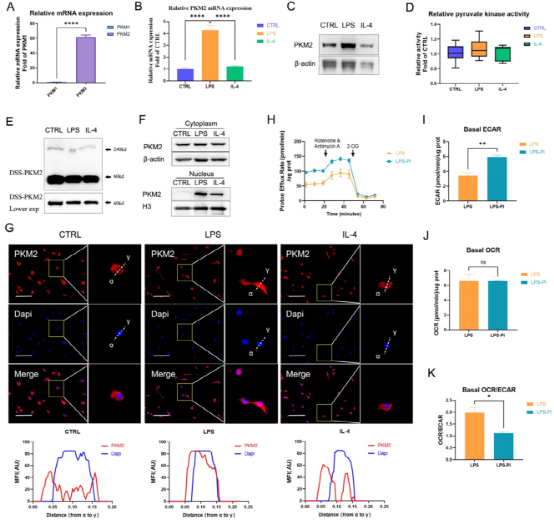
据文献报道,免疫细胞中PKM基因通过可变剪切可得到丙酮酸激酶异构体PKM1和PKM2。作者的实验结果显示naïve BMDM细胞中的PKM2的表达远高于PKM1(图1A)。100 ng/ml LPS诱导的巨噬细胞相比于naïve和IL-4诱导的巨噬细胞,可显著升高PKM2 mRNA的表达和蛋白水平(图1B-C)。尽管如此,但LPS并未影响丙酮酸激酶活性(图1D)。辛二酸二琥珀酰亚胺酯(DSS)交联的naïve BMDM细胞裂解液结果显示,LPS诱导的巨噬细胞中PKM2的四聚体形式低于naïve和IL-4诱导的巨噬细胞(图1E)。与PKM2的四聚体形式不同,二聚体/单体形式可以进入细胞核,蛋白免疫印迹和免疫荧光结果显示LPS诱导的巨噬细胞中,PKM2在细胞核的水平高于其它两组(图1F-G)。已有研究表明PKM2可调控Warburg效应。PKM2酶抑制剂(Compound 3K)显著增加了LPS诱导的巨噬细胞的糖酵解速率,但对OCR没有影响(图1H-J)。OCR/ECAR比值显示,PKM2酶抑制剂可促使LPS诱导的巨噬细胞向更高糖酵解的代谢转变(图1K)。以上结果表明PKM2在LPS诱导的巨噬细胞中高表达,以及PKM2酶抑制剂可增强Warburg效应,促进LPS诱导的巨噬细胞的炎症代谢适应。

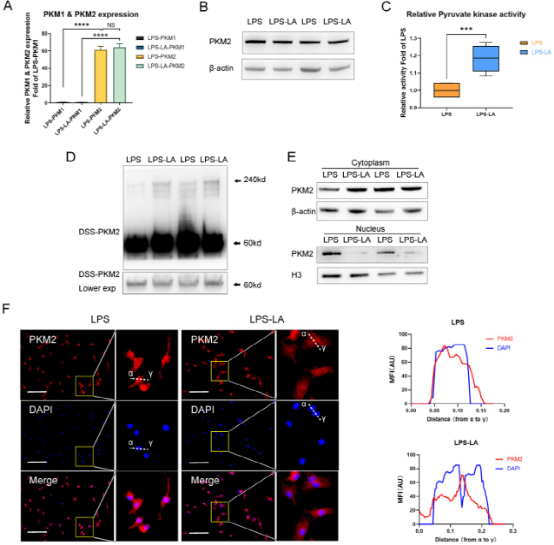
PKM2可调节糖酵解和乳酸生成,但不清楚乳酸是否调控PKM2。20mM乳酸外源干预并未影响LPS诱导的巨噬细胞中的PKM2的mRNA和蛋白表达(图2A-B)。但是,乳酸显著促进了LPS诱导巨噬细胞的丙酮酸激酶活性(图2C)。BMDM细胞裂解物的DSS交联结果表明LPS-LA组(乳酸干预组)的PKM2四聚体形态显著高于LPS组(图2D)。此外,LPS-LA组细胞核内PKM2水平明显低于LPS组(图2E-F)。这些结果表明乳酸激活了LPS诱导的巨噬细胞中的PKM2。

三、乳酸抑制糖酵解,并通过激活PKM2促进LPS诱导的巨噬细胞向修复表型的转变
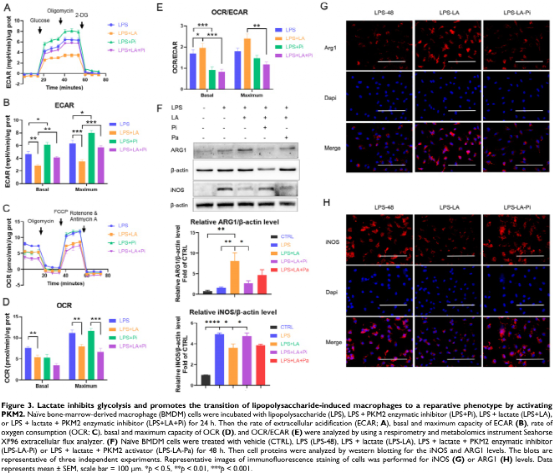
作者检测了外源性乳酸如何影响LPS诱导巨噬细胞的ECAR和OCR水平。结果显示乳酸显著降低LPS诱导的巨噬细胞的ECAR和OCR水平,但增加了OCR/ECAR比值,且外源性乳糖逆转了PKM2酶抑制剂对ECAR的增加和对OCR/ECAR比值的减少(图3A-E)。这些结果表明乳酸可能通过激活PKM2而损害LPS诱导的巨噬细胞的炎症代谢适应。随后,作者分析了乳酸是否通过激活PKM2促进LPS诱导的巨噬细胞向修复表型的转变。在LPS诱导的BMDM细胞中,乳酸可升高ARG1水平以及降低iNOS水平,然而,PKM2酶抑制剂逆转了上述结果(图3F-H)。这些结果说明乳酸通过激活PKM2促进LPS诱导的巨噬细胞向修复表型的转变。
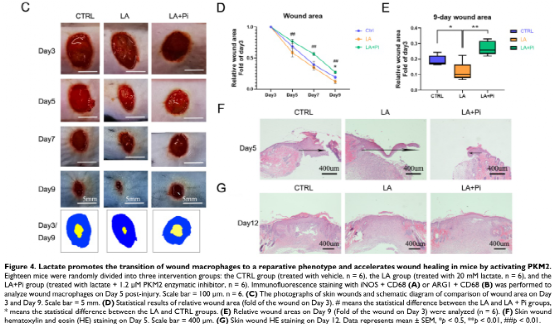
四、乳酸通过激活PKM2促进伤口巨噬细胞向修复表型的转变,加速小鼠伤口愈合
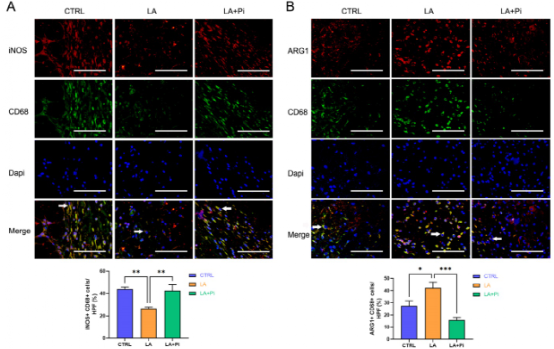
作者使用小鼠构建了皮肤伤口模型,在伤口造模后第3天和第5天给予外源性乳酸盐(20mM)局部处理。造模后第5天,乳酸干预组创面组织中促炎巨噬细胞(iNOS+ CD68+阳性细胞)明显降低,而修复性巨噬细胞(ARG1+ CD68+阳性细胞)水平高于对照组;然而,PKM2酶抑制剂又使促炎巨噬细胞增多,修复性巨噬细胞(ARG1+ CD68+阳性细胞)减少(图4A-B)。图4C-D显示乳酸促进了伤口愈合,但PKM2酶抑制剂阻碍了乳酸的作用(图4C-D)。数据显示,乳酸干预组第9天创面面积明显小于对照组,而PKM2酶抑制剂减弱了乳酸对创面愈合的促进作用(图4E)。另外,损伤后第5天,乳酸促进了皮肤上皮细胞的迁移能力,而PKM2酶抑制剂阻碍了乳酸对皮肤上皮细胞迁移的作用(图4F),但伤后第12天时,三组皮肤质量无明显差异(图4G),这表明乳酸干预并没有降低伤口的愈合质量。综上所述,在小鼠中,局部给药外源性乳酸通过促进PKM2促进伤口巨噬细胞从促炎表型向修复表型的转变以及加速伤口愈合。
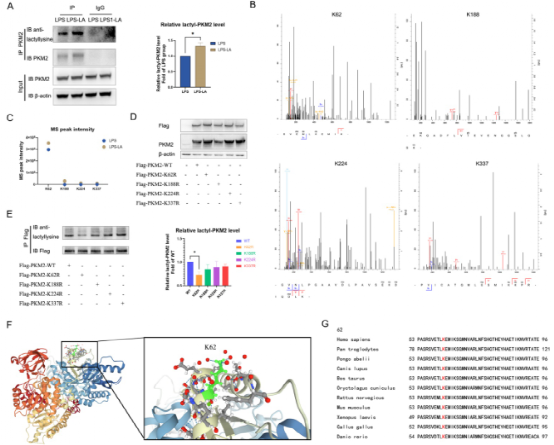
据报道,乳酸作为一种潜在的修饰底物,可以直接修饰蛋白质。目前尚不清楚PKM2是否存在乳酸修饰,以及乳酸修饰如何调节PKM2的功能。于是,LPS诱导的BMDM细胞中,作者使用PKM2抗体下拉PKM2,并使用抗乳糖赖氨酸抗体检测PKM2的乳糖化水平。结果显示,PKM2被乳酸修饰,在用20 mM乳酸处理24小时后显著增强(图5A)。在LPS诱导和LPS+乳酸诱导的BMDM细胞中,通过IP-质谱分析PKM2可能的乳糖化位点且发现乳酸干预后有四个位点(K62、K188、K224和K337)的MS峰值强度增加最显著(图5B-C),表明这些位点对乳酸处理后更敏感。然后,293T细胞中突变K62R、K188R、K224R、K337R位点以及过表达PKM2(图5D)。随后,采用标记抗体下拉PKM2检测乳酸水平。结果证实K62R位点突变明显减少PKM2的乳酸化,而其他3个位点突变对乳酸化水平无显著影响(图5E)。这些结果表明K62位点是PKM2的主要乳糖化位点。PKM2的三级结构显示K62位于PKM2蛋白的A结构域,毗邻一个关键的活性位点S362(图5F)。根据5G所示, K62保守的物种范围从斑马鱼到各种哺乳动物,这些证据支持K62位点是PKM2功能潜在调控位点的假设。

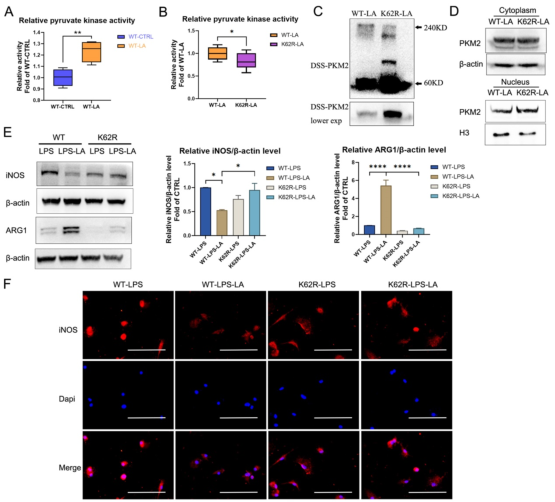
六、K62R突变体逆转了乳酸对PKM2酶活性和巨噬细胞表型转变的调节
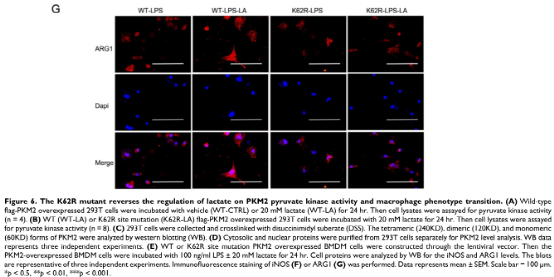
通过实验进一步评估了K62位点乳酸化对PKM2功能的调节作用。如图6A所示,乳酸显著促进了WT型PKM2过表达293T细胞中PKM2酶的活性,而K62R突变显著抑制了乳酸处理后293T细胞中的PKM2酶活性(图6B)。乳酸处理的293T细胞裂解物的DSS交联后发现K62R-乳酸组PKM2四聚体形态水平明显低于乳酸组(图6C)。此外,K62R-乳酸组细胞核内PKM2水平显著高于乳酸组(图6D)。这些结果证实了K62位点对PKM2的功能有显著影响,并证明乳酸通过K62位点促进PKM2酶活性。使用慢病毒载体在BMDM细胞中过表达K62R突变或WT PKM2。LPS孵育48 h后,乳酸增加了WT PKM2 BMDM细胞中ARG1水平但降低了iNOS水平,这些作用被过表达K62R-突变减弱(图6E-G)。以上结果说明乳酸在一定程度上通过PKM2在K62位点的乳酸化来促进LPS诱导的巨噬细胞向修复表型转变。
好啦,本期国自然热点文献乳酸化文献解读,结果在这里就全部分析完了,大家对这篇文献也有所了解了吧~
最后我们再来总结一下:
通过循序渐进的实验,一步一步地证实了作者提出的假说。首先,证明PKM2活性在巨噬细胞中对糖酵解的影响;其次,建立乳酸和PKM2活性的关系;再次,细胞和动物层面证明乳酸通过激活PKM2活性影响LPS诱导的巨噬细胞向修复表型的转变;然后,通过免疫沉淀和免疫沉淀-质谱确定PKM2的乳酸化位点;最后,通过突变K62位点检测乳酸对巨噬细胞表型转换的影响。


 2022-12-26 10:57:34
2022-12-26 10:57:34











