

泛素化看过,连续泛素化看过吗?(一)
 2021-12-24 15:48:13
2021-12-24 15:48:13
来源/作者:普拉特泽-生物医学整体课题外包平台
今天我们来看一篇文章
译:RNF 125和Cbl-b对NLRP 3的连续泛素化抑制炎症小体活化和缓解内毒素血症
JOURNAL OF EXPERIMENTAL MEDICINE( IF :14.307/Q1 )
复制点击此处直达原文:https://doi.org/10.1084/jem.20182091
泛素化是什么?
小编给一个沙雕版的理解方式:
就像“F4把Joker牌放到了杉菜的书包里说:我们要整你啦!
于是杉菜就被丢进了垃圾桶。”

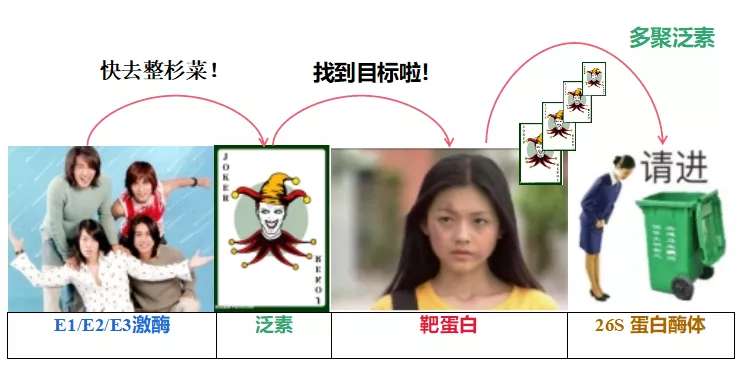
PS. 这里没有谁好谁坏的区分。被降解的靶蛋白是“好人”那就“不好”,被降解的靶蛋白是“坏人”那就“很好”。
本文中,被“F4”(RNF 125和Cbl-b)降解的“杉菜”(NLRP3)就是个“坏人”,它是炎症小体NLRP3,具有促进炎症反应的作用。
因此,研究者就探索了哪些泛素化过程可以“消炎”,拯救内毒素血症患者。
这里是正经点儿的关于“泛素化”过程的解释
【泛素化过程】相当于给不同的蛋白质打上不同的标签,从而被细胞内的一些其他酶复合体、细胞器去识别这些蛋白,从而实现其被26S蛋白酶体靶向降解作用。
【26S蛋白酶体】26S蛋白酶体就当它是一个垃圾回收工厂,识别并分解掉被多聚泛素打上标签的蛋白。
【泛素蛋白】是一个由76个氨基酸残基组成的“保守派”多肽,其本身带有7个赖氨酸残基,它在“好朋友”E1/E2/E3等激酶的帮助下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接,形成多泛素蛋白链,从而起到介导靶蛋白进入蛋白酶降解等作用。
→在研究结论上,作者发现了:
RNF125是介导NLRP3蛋白 LRR结构域发生K63位泛素化的E3泛素连接酶,并通过UBA结构域招募Cbl-b,进而Cbl-b在NLRP3的NBD结构域K496位点发生K48位多聚泛素化和随后的蛋白酶体降解。说人话就:RNF125(道明寺)招募Cbl-b(美作)把NLRP3(杉菜)丢进了垃圾桶26S蛋白酶体。

→在研究机制上,作者发现了:
NLRP3同时经历K63和k48连锁的多聚泛素化。Cbl-b通过其泛素相关区域(UBA)与NLRP3富亮氨酸重复结构域(LRR)上的k63 -泛素链结合,然后将NLRP3定位于K496位点,进行k48链接的泛素化和蛋白酶体介导的降解。同时还发现RNF125是一个额外的E3泛素连接酶,可启动NLRP3 LRR结构域的k63链接泛素化。继续说人话:RNF125(道明寺)首先向NLRP3(杉菜)丢出K63泛素化技能,杉菜被丢进一次垃圾桶;接着,Cbl-b(美作)又继续向NLRP3(杉菜)丢出K48泛素化技能,(杉菜)又被丢进垃圾桶一次,杉菜被Double Kill~!

→在研究意义上,作者认为:
E3泛素连接酶Cbl-b是通过caspase-11/ nlrp3依赖的方式预防亚致死剂量LPS诱导的内毒素血症;同时首次发现两种E3泛素连接酶RNF125及Cbl-b介导的新型连续泛素化过程,进而调控NLRP3炎性小体活性;最终在RNF125和Cbl-b的存在下,NLRP3炎症小体介导的内毒素血症得到了缓解。还是说人话:RNF125(道明寺)和Cbl-b(美作)对待NLRP3(杉菜)的恶行首次被班主任(本科研团队)揭发,只要“道明寺”和“美作”够多,“杉菜”导致的内毒素血症,就可以被缓解!
这是本文的研究思路图
名词释义
【内毒素血症】:是由于革兰氏阴性菌细胞壁内的一种脂多糖在细菌死亡后释放入血液,引起发热等一系列的临床综合征。
【NLRP3炎性小体】:核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)是炎症小体中关键的调控蛋白之一,作为固有免疫的重要组分在机体免疫反应和疾病发生过程中具有重要作用。
【Cbl-b】:Casitas-B系淋巴瘤蛋白-b (Cbl-b)是一种RING finger E3泛素连接酶,在T细胞活化、耐受诱导和分化中起着至关重要的作用。
【RNF125】:一种E3泛素连接酶,作者额外发现该酶参与连续泛素化中。
文章整体概况
作者首先用ELISA测定相关炎症因子,来阐明巨噬细胞中Cbl-可选择性抑制由不同毒素诱导经典及非经典NLRP3炎性小体的IL-1β释放,而并不抑制TLRs信号通路。之后在腹腔注射LPS(5 mg/kg)及盲肠结扎穿刺诱导的内毒素血症模型中,发现Cbl-b基因缺失小鼠更易致死。因此认为Cbl-b可能是内毒素血症缓解的重要因子。(也就是说:Cbl-b,棒!)
下一步发现,导致Cblb−/−小鼠死亡的主要原因不是细胞焦亡,而是异常增加的IL-1β及随后增加的TNF-α;之后作者对这两者的抑制验证进一步证明了此观点。(也就是说:LPS诱导内毒素血症的致死因,就!是!这!两!个!炎!症!因!子!的!升!高!不是焦亡哦!)
在体外(Cblb−/−细胞和小鼠)实验中进一步确认,Cbl-b主要降低由NLRP3依赖性的IL-1β释放,从而抑制由LPS诱导的内毒素血症的发展,Cbl-b是调控内毒素血症的重要分子。
总的来说,作者认为LPS诱导的内毒素血症可活化经典及非经典炎性小体通路,而Cbl-b主要调控IL-1β的释放,已知固有免疫细胞中Cbl-b表达是抑制LPS诱导的内毒素血症的关键因素。(那么Cbl-b和NLRP3就可能:有!点!关!系!)
者接下来就开始研究它俩有没有关系,又是啥关系:用COIP判断确实有联系,之后又通过突变结合域的方式发现Cbl-b UBA结构域与NLRP3 LRR结构域相结合,发现结合于NLRP3蛋白LRR结构域泛素链的Cbl-b在NLRP3发生的蛋白酶体降解中发挥重要作用。(就是,作者先确定他们之间有物理连接,然后通过突变泛素链上的相关结合域,他们找到了Cbl-b与NLRP3的连接点)
泛素链与NLRP3 LRR结构域的连接以及它们与Cbl-b UBA区域的关联表明,除了Cbl-b之外,还有个E3泛素连接酶还参与了NLRP3 k63连接的泛素化起始过程。
通过GST-NLRP3、质谱分析及免疫共沉淀等实验,有了意外收获,他们鉴定出RNF125是介导NLRP3蛋白 LRR结构域发生K63位泛素化的E3泛素连接酶,并通过UBA结构域招募Cbl-b,进而在NLRP3的NBD结构域K496位点发生K48位多聚泛素化和随后的蛋白酶体降解。 (先是RNF125泛素化NLRP3之后再由Cbl-b泛素化NLRP3,形成连!续!泛!素!化!)
因此,作者首次发现两种E3泛素连接酶RNF125及Cbl-b介导的新型连续泛素化过程,进而调控NLRP3炎性小体活性;最终在RNF125和Cbl-b的存在下,NLRP3炎症小体介导的内毒素血症得到了缓解。
本文的简介就到这里
对脓毒症、炎症小体、泛素化研究感兴趣的小伙伴,可点个关注哦
下一篇推送:【结果导读】
