

定点突变实验步骤【新手入门】
 2021-05-07 14:09:37
2021-05-07 14:09:37
来源/作者:普拉特泽生物-医学整体课题外包
目前,由PCR介导的定点突变相比于其他突变技术具有周期短、成功率高、不受酶切位点限制等优点,是使用最普遍的定点突变方法。
DNA分子中由于发生碱基对的增添、缺失或改变进而引起基因结构的改变,称为基因突变。
定点突变 (mutagenesis)是通过PCR等方法向目的DNA片段中引入突变,包括碱基的添加、删除、点突变等。该技术能迅速、高效地改变DNA所表达的目的蛋白的性状及表征,是研究蛋白质结构和功能之间复杂关系的有力工具,也是研究人员在实验室中改造、优化基因常用的一种非常有用的手段。
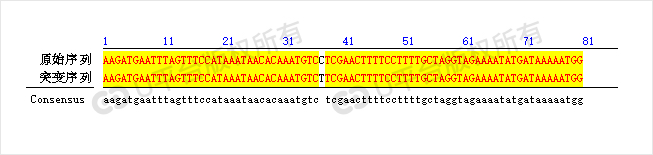
定点突变这么常见的技术,实验如何进行呢?
一步法(直接以质粒为模板)。为了更好的扩增效率,可以将正因和反向引物分开扩增,避免二聚体的产生。实验流程如下(转载自科学网mzxg的博客):
1、引物设计
设计一对正向和方向引物。建议引物长度为30-40bp。
基本的引物设计原则就不赘述了,这里要加上一条突变引物的设计原则。
一般是以突变的碱基为中心,两边加上12-20 bp序列,若两边引物太短了,很可能会造成突变实验失败,引物至少要11-12个base pair才能与模板搭上,而这种突变PCR要求两边都能与引物搭上,所以两边最好各设至少12个base pair,并且合成多一条反向互补的引物。
2、各20ul体系
18ul 混合物+2uL primer F
18ul 混合物+2uL primer R
在两个tube中配好反应体系后,置于PCR仪进行反应,反应程序为:
98℃ 1 min
98℃ 10sec
60℃(可调整) 20sec
72℃ 根据质粒大小调整
steps 2-4 for 12 cycles
72℃ 5 min
4℃保存
3、反应完成后,将两个反应体系混合后成40ul体系,并且补加适量的高保真聚合酶(如Q5),然后使用以上反应程序继续反应16 cycles。
4、得到的PCR产物加入1ul DpnI 酶和4ul的10*NEB cutsmart buffer消化模板质粒(原理是DpnI 酶只消化甲基化的DNA)置于37度反应1h(或者2-3h,保证处理干净)。
5、取5ul 跑胶看是否有条带,剩余的取部分做细菌转化,涂板。
6、12h 后挑取3-5个克隆送测序。
除了一步法,还有很多其他方法可以选择,比如搭桥法/重叠延伸PCR,是通过三次PCR实现的。
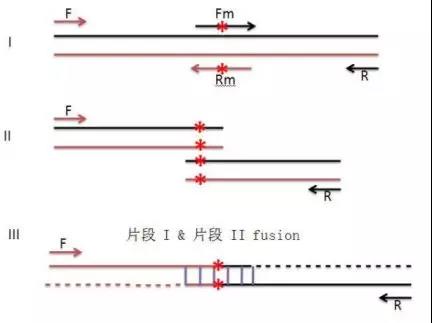
重叠PCR法原理图
每个突变点需要合成一对相互Overlap(重叠)20-25bp的突变引物,你的试验中需合成4对(4个点)突变引物。 另外两侧需要合成一对引物,以便扩增全长序列(称为全长引物)。
举一突变点为例,如需突变A点。先作两个PCR:1使用正向全长引物和A突变点的反向突变引物;2突变点A的正向突变引物和全长反向引物。而后回收两段PCR产物,取少量产物在PCR体系中先自延伸十周,而后加入正向和反向全长引物扩增全片断。回收第二轮的PCR产物,酶切,接入克隆载体,测序。测序结果如正确则第一个位点突变完成。 以此类推,突变剩下的位点。
优点是:成功率高,应用广泛。
缺点是:扩增的序列尽量不要太长,否则成功率不高。需要对中间产物进行纯化。
倘若质粒模板无法正常扩增,可能的原因有哪些?有哪些解决方法呢?点此跳转
