

看circRNA编码蛋白!
 2021-09-22 18:02:54
2021-09-22 18:02:54
来源/作者:普拉特泽生物-医学整体课题外包

译: CircDIDO1通过编码新的DIDO1-529aa蛋白和调节PRDX2蛋白稳定性抑制胃癌进展
MOLECULAR THERAPY (IF:11.454/Q1) DOI:/10.1016/j.ymthe.2021.08.025
话不多说,我们先来看这篇文章的研究思路图
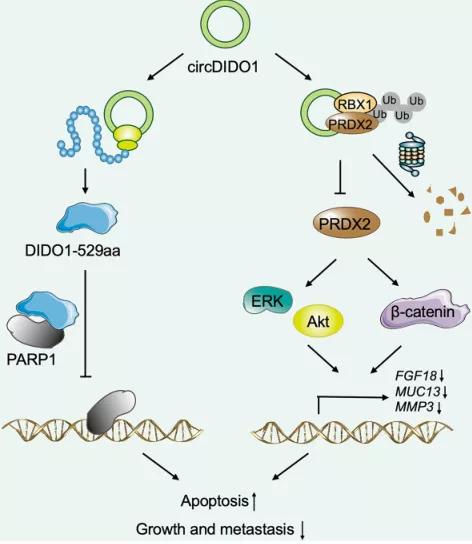
circDIDO1在胃癌中的作用机制的建议模型
(CircDIDO1是一种新的GC抑瘤环状RNA。 circDIDO1通过编码DIDO1-529aa蛋白抑制PARP1活性,促进rbx1介导泛素化和PRDX2降解,从而抑制GC的生长和侵袭性)
注: GC细胞=胃癌细胞
DIDO1=(死亡诱导因子消除因子1)基因(称为circDIDO1)
看图得结论:本文集合了circRNA研究的2大热点:
① circRNA编码多肽蛋白
②circRNA结合蛋白并促进泛素化降解
● 在结论上,作者发现了:
一种新的环状RNA,即circDIDO1,在GC中具有强大的抑癌活性。 可分别通过抑制PARP1和促进PRDX2泛素化降解,一起抑制GC细胞的生长和侵袭性。

● 在机制上,作者发现了:
circDIDO1编码了一个新的529 aa蛋白,该蛋白直接与聚adp -核糖聚合酶1 (PARP1)相互作用并抑制其活性。 CircDIDO1还特异性结合过氧化物还原蛋白2 (PRDX2),促进rbx1介导的PRDX2的泛素化和降解,导致其下游信号通路失活。

●在研究意义上,作者认为:
研究扩展了对circRNA在胃癌发病机制中的作用的理解,并提出了一种新的circRNA,circDIDO1作为GC的潜在生物标志物。

接下来枯燥且正经的学习开始了,赶紧学套路,发10分!
研究方法:
通过生物信息学分析确定hsa_circ_0061137(称为circDIDO1)在GC中的异常表达。 进行了功能获得和功能丧失的研究,以检查circDIDO1在GC进展中的生物学作用。 并采用标记RNA亲和纯化、质谱、免疫荧光、免疫共沉淀和Western blot方法鉴定环状RNA相互作用和环状RNA编码的蛋白。 之后通过RNA-seq、RT-qPCR和Western blot分析circRNA调控的下游靶基因和信号通路; 最后采用小鼠肿瘤模型分析circDIDO1对胃癌生长和转移的影响。
看到这里是不是觉得...

确实! 小编也这么觉得,所以。 。 。
还不快赶紧学起来自己也整个10分?!

Come,过一下这篇文章的结果,想学的赶紧码。
1、CircDIDO1在GC中下调,低水平预示预后不良
为了鉴定GC中新的环状RNA,从Gene Expression Omnibus 中提取了环状RNA芯片数据(GSE83521和GSE89143)分析circRNA表达谱。(不自己做测序,空手套白狼你学废了嚒? )通过对这两组数据集的差异表达环状RNA进行交叉,作者确定了8个与相邻正常组织相比在GC组织中显著下调的环状RNA(图1a)。 考虑到相对表达水平和检测特异性,作者选择hsa_circ_0061137作为下一步研究的目标。 Hsa_circ_0061137是由长度为1787个核苷酸(因此称为circDIDO1)的DIDO1 (death inducer obliterator 1)基因线性转录本的外显子2-6的反向剪接形成的(图1b)。 PCR结果显示,从GC细胞的cDNA中扩增circDIDO1,而从gDNA中扩增不出circDIDO1,而从两者中聚合的引物均能扩增线性转录本(图1c)。 由此可见,测序结果证实了不同引物扩增的PCR产物中存在反向剪接位点(图1b)。RNAse R降解试验结果表明,线性转录的DIDO1被RNAse R处理降解,而circDIDO1对该处理具有抗性(图1d)。 RNA-FISH检测结果显示circDIDO1分布于GC细胞的细胞核和细胞质中(图1e)。 综上所述,这些结果表明circDIDO1是GC中新发现的环状RNA。 然后作者检测circDIDO1在人胃癌细胞和组织中的表达。 QRT-PCR结果显示,与正常胃黏膜上皮细胞相比,circDIDO1在GC细胞中明显下调(图1f)。 此外,作者检测了102对胃癌患者肿瘤组织和正常组织中circDIDO1的表达,发现与配对正常组织相比,circDIDO1在胃癌患者肿瘤组织中的表达明显下调(图1g)。 CircDIDO1表达水平与肿瘤大小和远处转移呈负相关(表S1)。 此外,circDIDO1水平低的GC患者的生存时间明显短于高水平的GC患者(图1h)。 综上所述,这些结果表明circDIDO1在GC中低表达,其下调预示预后不良。
这段circRNA鉴定的操作看完的感想来,大声告诉我:

是不是搁你你也会?
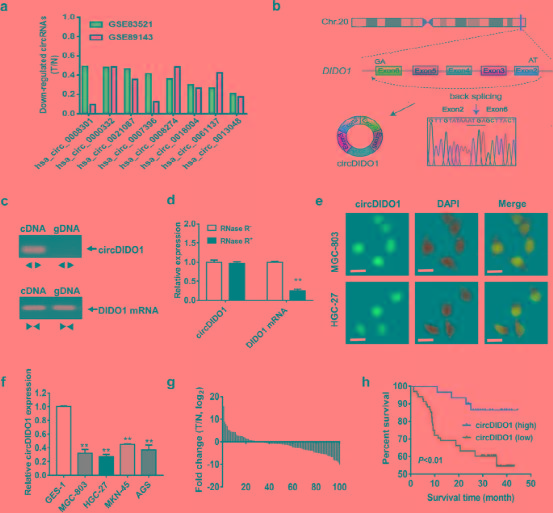
图1: CircDIDO1被鉴定为GC中下调的circRNA
2、CircRNA在胃癌中具有抑癌作用
接下来,通过功能增益和功能缺失研究探索circDIDO1在GC中的生物学作用。 细胞生长、菌落形成、transwell迁移、基质侵袭分析和流式细胞术分析结果显示,circDIDO1过表达显著抑制了增殖(图2a和2b)、迁移(图2a和2b)。 2c)和GC细胞的侵袭能力(图2d),同时促进其凋亡(图2e)。 相反,circ-DIDO1基因敲除有相反的效果(图S1)。 然后评估了circDIDO1对小鼠模型GC生长的影响。 如图2f所示,circDIDO1过表达组在接种30天后肿瘤的重量明显低于对照组。 免疫组化染色结果显示,与对照组相比,circDIDO1过表达组ki -67阳性增殖细胞百分率降低,tunel阳性凋亡细胞百分率升高(图2g)。
为了分析circDIDO1对胃癌转移的影响,作者通过向裸鼠腹腔注射控制和circDIDO1过表达细胞建立了腹腔转移模型。 4周后处死裸鼠,观察腹腔转移灶和肝转移灶。 与对照组相比,circDIDO1过表达组肠系膜肿瘤体积和重量明显变小(图2h)。 由此可见,circDIDO1过表达组的肝转移数量明显低于对照组(图2h)。 免疫组化染色结果显示,与对照组相比,circDIDO1过表达组肝转移组织中EMT标记物E-cadherin表达明显上调,N-cadherin表达下调(图S2a)。 这表明,circDIDO1在胃癌中具有抑癌作用。

图2: CircDIDO1过表达抑制GC的生长和转移
这段circRNA对肿瘤细胞的体内外作用看完的感想来,大声告诉我:

是不是搁你你也会?
3、CircDIDO1编码一个529aa肿瘤抑制蛋白
通过circRNADb软件进行的生物信息学分析显示,circDIDO1具有核糖体进入位点(IRES)、开放阅读框(ORF)和m6A修饰(图S3a),表明它可能具有编码蛋白质的潜力。 circDIDO1的反向剪接位点形成一个终止密码子(这里是亮点,注意看! 怎么分析circRNA具有编码aa的潜力! Maybe你还没学会,嘘~)。 circDIDO1预测的ORF可能编码一个推测的529 aa蛋白(图3a),称为DIDO1-529aa。 当用针对DIDO1蛋白的抗体检测时,作者发现circDIDO1过表达生成了一个分子量接近DIDO1的新蛋白(图S3b)。 CircDIDO1过表达对DIDO1基因表达无影响(图S3c)。
为了证实circDIDO1具有蛋白编码能力,在circDIDO1全长序列的最后一个核苷酸(即circDIDO1的预测终止密码子)前构建了一个带有FLAG标签的circDIDO1过表达载体(circDIDO1- FLAG),并将其转染到293 T细胞中。 Western blot结果显示,FLAG抗体可检测新生蛋白的表达,说明circDIDO1具有蛋白编码能力(图3b)。 随后,用抗flag抗体对新生蛋白进行IP纯化,进一步验证。 液相色谱-质谱联用结果表明,新生蛋白的氨基酸序列与预测蛋白完全匹配,证实DIDO1-529aa是circDIDO1翻译而来(图3c和图S3d)。 然后将DIDO1-529aa的氨基酸序列与DIDO1蛋白的氨基酸序列进行比较。 作者发现DIDO1-529aa与DIDO1蛋白亚型a (DIDO1-a)具有相似的氨基酸序列。 与DIDO1-a相比,DIDO1-529aa失去了c端最后33个氨基酸,即DIDO1-a的核输出序列(NES)(图3d)。(这里是亮点,注意看! 这个circRNA编码出来的DIDO1-529aa没有核输出序列,所以翻译出来后只要进了细胞核就出不去啦! )作者进一步通过免疫荧光法确定了DIDO1-529aa在GC细胞中的分布,发现DIDO1-529aa主要定位于细胞核(图3d)。 (这里有一点嗷~~小编弱弱提示下,作者没有说这个DIDO1-529aa有没有核定位序列嗷,如果没有核定位序列,仅缺少核输出序列,也是会在胞质里的嗷~~当然我们看IF结果,应该是DIDO1-529aa有NLS但没有NES嗷~~)为了进一步探讨DIDO1-529aa的功能,作者构建了带Flag标签的线性形式的DIDO1-529aa载体(DIDO1-529aa-Flag),并将其转染到GC细胞中。 功能检测结果显示,过表达DIDO1-529aa可抑制GC细胞增殖、迁移和侵袭,但可促进GC细胞凋亡(图3e-i)。 综上所述,这些发现表明circDIDO1编码一个具有抑癌活性的529aa蛋白。
这段circRNA对编码aa看完的感想来,大声告诉我:

是不是搁你你就不一定会了?
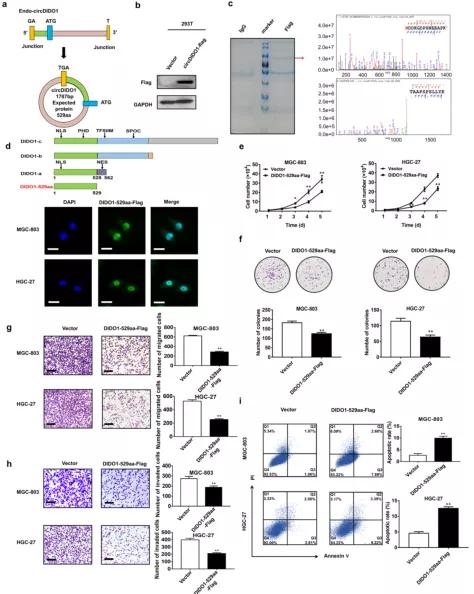
图3. CircDIDO1编码一个新的529 aa蛋白
4、CircDIDO1干扰GC细胞中PRDX2的下游通路
为了分析circDIDO1调控的下游信号通路,对控制和circDIDO1过表达的GC细胞进行了RNA-seq,并对基因表谱进行了聚类和通路分析(图6e,f)。(注意哦~10分以上的原创高通量测序来了! )与对照组相比,circDIDO1过表达组中有134个基因表达上调,52个基因表达下调(表S4)。 通过qRT-PCR验证了circDIDO1过表达组中几个已鉴定基因的表达改变(图S6)。 通路分析表明,差异表达基因在与癌症进展密切相关的信号通路中富集,如Wnt/β-catenin、MAPK和PI3k/ Akt通路(图6f)。 前期研究表明PRDX2蛋白是这些通路的关键调控因子。 为此,作者检测了circDIDO1是否通过下调GC细胞中的PRDX2来调控这些通路。 Western blot结果证实circDIDO1在GC细胞和肿瘤组织中,过表达使这些通路失活(图6g和图S2b),这与在PRDX2敲低的GC细胞中观察到的变化模式相似。 特别是circDIDO1过表达抑制了GC细胞中β-catenin的表达和活性(图6h和图S7),这与之前的研究一致,PRDX2是其他癌细胞中β-catenin信号通路的重要调控因子。
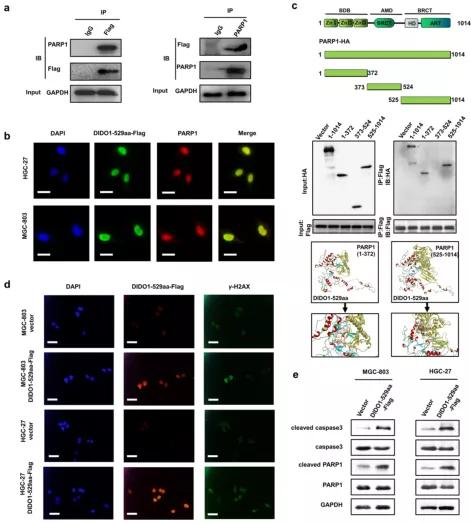
图4. DIDO1-529aa与PARP1相互作用
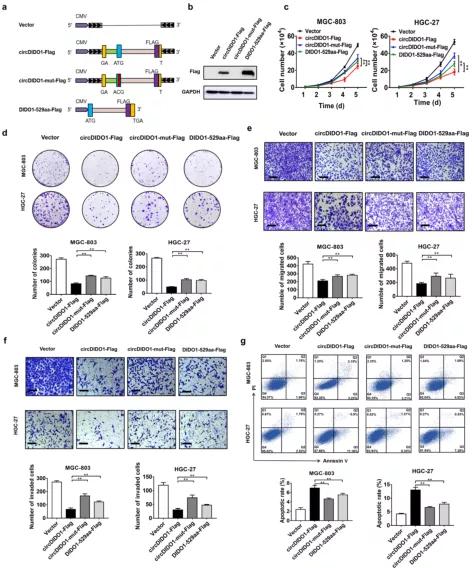
图5: CircDIDO1通过双重机制在GC中发挥抑癌作用
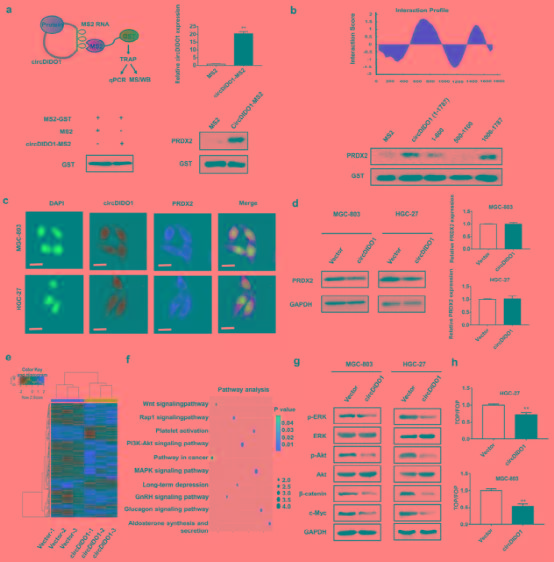
图6: CircDIDO1与GC细胞中的PRDX2蛋白相互作用
5、CircDIDO1促进RBX1介导的泛素化和PRDX2的降解
进一步用MG-132检测circDIDO1是否调节PRDX2蛋白的稳定性。 发现MG-132预处理可防止circDIDO1过表达诱导的GC细胞中PRDX2蛋白的降解(图7a)。 与此相一致,环己亚胺(CHX)检测结果显示,circDIDO1过表达组的PRDX2蛋白半衰期短于对照组(图7b),表明circDIDO1加速了PRDX2蛋白在GC细胞中的降解。 为了分析circDIDO1是否通过泛素化依赖机制促进PRDX2蛋白降解,作者利用PhosphoSite Plus软件预测PRDX2蛋白中潜在的泛素修饰位点。 作者发现PRDX2蛋白具有多个泛素修饰位点(图7c)。 然后作者将circDIDO1与泛素共转染GC细胞,并用MG-132处理转染的细胞。 Co-IP检测结果显示circDIDO1过表达显著增加了泛素化PRDX2蛋白的水平(图7d)。 然后作者通过Co-IP和质谱分析检测PRDX2结合蛋白,发现PRDX2与一系列泛素连接酶结合(图7e和表S4)。 作者证实,PRDX2与SCF泛素化复合物的E3连接酶RBX1结合(图7f), circDIDO1过表达显著促进了PRDX2和RBX1蛋白之间的相互作用(图7g)。 总的来说,这些数据表明circDIDO1在GC细胞中促进rbx1介导的PRDX2泛素化和降解。
这段circRNA介导蛋白的泛素化降解看完的来,大声告诉我:

是不是搁你你就不一定会了?
但是我发现好像circRNA在这里也仅仅是一个促进的作用,并没有和机制图中画的那样直接结合上去了~~
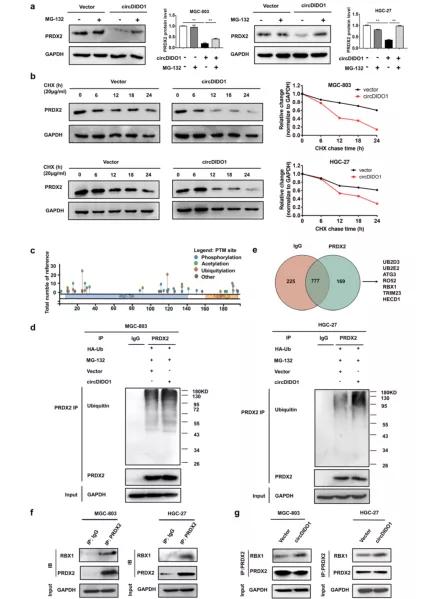
图7: CircDIDO1促进PRDX2的泛素化和RBX1的降解
好了,文章就到这里了。 看完是不是觉得自己又行了? ! ! !
我还能做实验!
有感兴趣的大漂亮大帅锅,记得关注我们,么么哒


