

Autophagy教你怎样做自噬的泛素化调节
 2022-02-08 12:00:21
2022-02-08 12:00:21
来源/作者:普拉特泽-生物医学整体课题外包平台
SQSTM1/p62这个很熟悉吧?
做自噬研究的小朋友应该都对它十分了解了。
不熟悉的小朋友请往下看:

SQSTM1/p62作为信号枢纽和选择性自噬受体,参与包涵体的形成和自噬过程。
自噬途径的许多关键成分都经历了泛素化修饰,而这种修饰已被证明在自噬调控中发挥重要作用。
SQSTM1的泛素化也会发生,并且在泛素胁迫下显著升高。泛素化已经被证明可以调节SQSTM1的活性。
前期研究发现了几种重要的泛素连接酶,根据它们的泛素化位点,抑制或促进SQSTM1的功能,我已经帮大家整理好了:

TRIM21
E3泛素连接酶TRIM21:直接与PB1结构域内的lysine 7 (K7)位点SQSTM1相互作用并泛素化。这种泛素化作用显著削弱SQSTM1的寡聚化,进而抑制了其隔离功能。
RNF166
E3连接酶RNF166:催化K29,K33,K91,和K189位点上的多聚泛素化。RNF166介导的泛素连接酶活性促进SQSTM1在细胞内细菌的外食性降解中的作用。
NEDD4
E3泛素连接酶NEDD4:与SQSTM1相互作用并泛素化以实现包涵体自噬。
Cullin 3
KEAP1-CUL3 (cullin 3):在其UBA结构域的K420处泛素化SQSTM1,以增强SQSTM1的隔离活性和自噬降解。K420的泛素化可能会破坏二聚化,从而释放SQSTM1识别多泛素化载体的能力以进行选择性自噬。泛素胁迫诱导K420的泛素化,从而提高大体积和选择性自噬的通量。
以上都是泛素化酶对SQSTM1的作用。但目前,SQSTM1特异性的去泛素化酶还未被鉴定出来。
那么,本文的主角

就要出场啦!

看表情包干嘛?一起愣着,别学习啊!

本文高光:
1. USP8(泛素特异性肽酶8)直接与SQSTM1相互作用并去泛素化。优先去除SQSTM1中赖氨酸11 (K11)连接的泛素链。
2. USP8主要在其UBA域内K420位点去泛素化SQSTM1。
3. USP8抑制了SQSTM1野生型细胞的自噬流,但抑制了其突变体K420的自噬流。
结论:
USP8通过在K420位点去泛素化SQSTM1,成为自噬的负调控因子。

速度看fig(s)~
Fig1:USP8与自噬受体SQSTM1相互作用:
为何选择USP8与SQSTM1作为研究对象?
SQSTM1被鉴定为非典型蛋白激酶C亚型的支架蛋白,定位于溶酶体靶向的内吞体。推测内含体相关的去泛素化酶可能调节SQSTM1的泛素化。USP8/UBPY同样位于内吞体,可调节包括表皮生长因子(EGF)受体在内的许多蛋白质的内体分选。因此推测USP8可能与SQSTM1相互作用并调节其泛素化。
作者通过co-ip、GST pulldown、截断式co-IP、免疫荧光共定位等方式,结果都指向USP8与自噬受体SQSTM1有结合关系。


Fig2:USP8在体外和体内均能去泛素化SQSTM1:
考虑到USP8是一种去泛素化酶,接下来作者确定USP8是否在体内和体外都可以作为去泛素酶作用于SQSTM1的去泛素化。体内外实验都验证了USP8显著降低了SQSTM1泛素化的水平(图2a、b)。
后续实验观察到USP8能够减少蛋白酶体抑制和热休克等应激条件下胁迫条件诱导的SQSTM1的泛素化(图2D)。泛素化的SQSTM1,连同泛素化的载体,不断被招募到生长中的自噬体中进行溶酶体降解。在基础条件下,细胞中几乎没有被泛素化的SQSTM1。在BafA1(一种通过阻断自噬体/溶酶体融合来抑制自噬的抑制剂)处理的MEF中敲除内源性USP8,显著增强了内源性SQSTM1的泛素化种类(图2E)。这些结果表明USP8是一个SQSTM1去泛素酶。

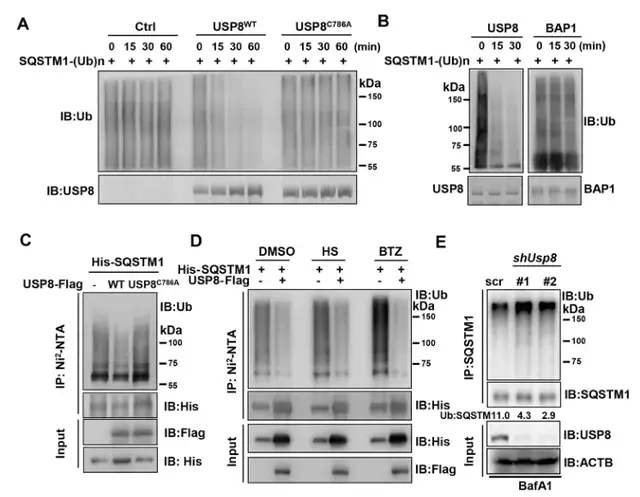
Fig3:USP8优先从SQSTM1中去除k11连接的泛素链:
冷知识:泛素蛋白本身携带7个赖氨酸残基,已经链接到底物蛋白上的泛素分子的赖氨酸残基可以继续发生泛素化修饰,形成泛素链。据报道,SQSTM1可被K29、K33、K48和K63连接的多聚泛素链修饰。而USP8已被证明可以去除K48、K63、K11和K6连接的泛素链。
但作者的结果证实:USP8可以显著抑制WT和K11泛素链的泛素化,较小程度上抑制K48和K63泛素化,对其他的泛素链无影响(图3a)。
在敲除USP8的细胞中,只有K11链接的泛素链中SQSTM1泛素化显著上调(图3b),而USP8敲低并没有增加细胞中内源性SQSTM1的K63和K48连接的多泛素化(图3c)。
得出结论,USP8会优先从SQSTM1中去除K11链接的泛素缀合物。

Fig4:USP8主要在K420位点去泛素化SQSTM1:
前期质谱分析发现SQSTM1上有多个泛素化位点,包括PB1和UBA结构域内的赖氨酸残基。接下来作者想判断SQSTM1的哪些赖氨酸残基可能受到USP8的影响。有报道称,UBA结构域中的K420残基是SQSTM1上的主要泛素化位点。K420的泛素化增强了SQSTM1的隔离活性和选择性自噬。因此,作者开始研究USP8对K420泛素化的影响。
与野生型SQSTM1相比,SQSTM1K420R突变体上附着的HA-Ub数量显著减少,但USP8过表达对SQSTM1K420R突变体的泛素化没有明显影响。在敲除USP8的细胞中,只有K11链接的泛素链中SQSTM1泛素化显著上调(图4a)。正如预期的那样,USP8过表达对K48或K63连接的SQSTM1K420R的泛素化没有显著影响。
KEAP1 (kelch-like ECH-associated protein 1)最近被证明在K420处泛素化SQSTM1,以增强SQSTM1的螯合活性和自噬降解。作者试图确定USP8是否与KEAP1竞争SQSTM1在K420位点的泛素化。USP8过表达抑制了KEAP1过表达引起的野生型SQSTM1的泛素化作用。这种效应在SQSTM1K420R突变体中没有观察到(图4c)。因此,USP8拮抗KEAP1使SQSTM1在K420位点泛素化。总的来说,这些结果表明USP8主要去除SQSTM1在K420位点的泛素化。


Fig5:USP8抑制SQSTM1的自噬降解:
有报道称,SQSTM1的K420处泛素化可增强SQSTM1的隔离活性和自噬降解。前面已经验证了USP8在K420残基上去泛素化SQSTM1。作者推断USP8可能有调控SQSTM1的自噬降解的作用。
通过过表达USP8和敲降,还有分析SQSTM1蛋白的半衰期,作者发现USP8在维持SQSTM1蛋白的稳定性中发挥了关键作用。而SQSTM1的降解主要是通过自噬介导的,因此自噬途径的破坏会导致细胞中SQSTM1蛋白的积累。
但USP8敲除并没有导致自噬缺失的ATG7-/- mef中SQSTM1蛋白水平的降低。这些结果表明USP8可以保护SQSTM1免受自噬降解。

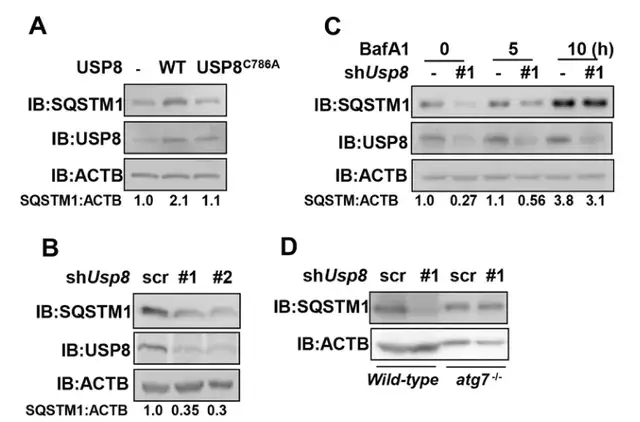
Fig6:USP8负调控自噬:
SQSTM1在其UBA域的K420位点泛素化增强了SQSTM1介导的泛素化载体招募到自噬体进行降解。SQSTM1是一种众所周知的选择性自噬底物,SQSTM1的减少被认为是自噬通量增加的指标。USP8在K420位点去泛素化SQSTM1并抑制其自噬降解,提示USP8可能在自噬小体的形成和自噬通量中发挥重要作用。
场外:BafA1可阻止自噬体-溶酶体融合,随后导致LC3-II的积累,它与自噬体膜紧密结合,并作为自噬的标志。
BafA1导致了LC3-II的累积,过表达USP8降低了LC3-II的累积(图6a)。敲低USP8,细胞中LC3-II的水平升高(图6b)。而在硼替佐米处理后,USP8敲除的HeLa细胞比对照组的细胞产生了更大的SQSTM1聚集物(图6c)。USP8敲低显著增加了自噬溶酶体的形成,这表明USP8敲除显著增加了自噬溶酶体的形成(图6d)。总的来说,这些结果表明USP8是基础自噬的负调控因子。
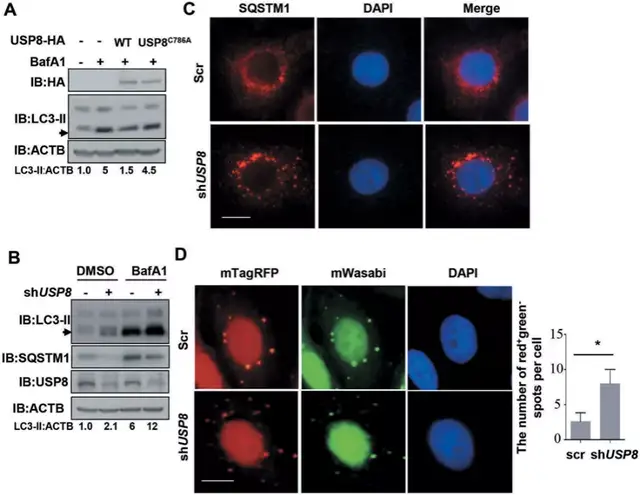
Fig7:USP8通过直接去泛素化SQSTM1的K420来调节SQSTM1的降解和自噬:
自噬的激活可以诱导SQSTM1降解,USP8可能通过调节其他底物影响SQSTM1降解和自噬。接下来,作者尝试研究USP8是否通过在K420位点去泛素化SQSTM1来影响SQSTM1蛋白水平和自噬。
敲除USP8对sqstm1−/-mef中的LC3-II水平无显著影响(图7a);而USP8过表达并没有明显改变这些细胞中SQSTM1K420R突变体中LC3-II的水平。这些结果表明,USP8通过在K420使SQSTM1去泛化来调节SQSTM1的活性和自噬。

你看懂了吗?
没看懂没关系,先收藏起来
等到下次写标书的时候
再好好参考
我们下期再见~

