

如何建立稳定的脑缺血再灌注损伤模型?关键技巧分享
 2025-04-21 17:35:30
2025-04-21 17:35:30
来源/作者:普拉特泽-生物医学整体课题外包平台
如何建立稳定的脑缺血再灌注损伤模型由普拉特泽生物为大家总结分享,普拉特泽生物动物实验平台专业承接裸鼠成瘤实验外包、动物造模等动物实验代做服务,积累专业丰富的实验操作经验,脑缺血再灌注损伤决方案,帮助研模型是研究脑卒中病理机制和药物评价的重要工具。本文将详细介绍建立稳定可靠的脑缺血再灌注损伤模型的关键技巧,包括动物选择、手术操作要点、质量控制标准和常见问题解究人员提高模型成功率和实验可重复性。
一、模型建立前的准备工作
1. 实验动物选择
品系选择:
大鼠:首选SD或Wistar大鼠(体重280-320g)
小鼠:C57BL/6(体重22-25g)
年龄控制:选择12-14周龄成年动物
饲养环境:恒温(23±1℃)、恒湿(50±10%)、12h/12h光暗周期
适应性饲养:至少3天适应期

2. 主要试剂与仪器
①必备器械:
显微手术器械套装
体温维持系统
激光多普勒血流仪
血气分析仪
②关键试剂:
水合氯醛/异氟烷麻醉剂
肝素钠溶液
硅胶涂覆尼龙线栓(直径规格匹配动物体重)
二、标准化手术操作流程(以MCAO线栓法为例)
1. 麻醉与术前处理
麻醉方案:
诱导:4%异氟烷
维持:1.5-2%异氟烷(推荐吸入麻醉)
术前用药:
阿托品(0.05mg/kg,sc)减少呼吸道分泌物
肝素钠(50U/kg,ip)预防血栓形成
2. 手术关键步骤
颈部正中切口(约1.5cm)
分离颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)
ECA远端结扎并剪断(形成"残端")
ICA近端临时阻断(微动脉夹)
线栓插入(从CCA分叉处向ICA推进):
▲大鼠:插入深度18-20mm
▲小鼠:插入深度10-12mm
▲固定线栓(结扎CCA近心端)
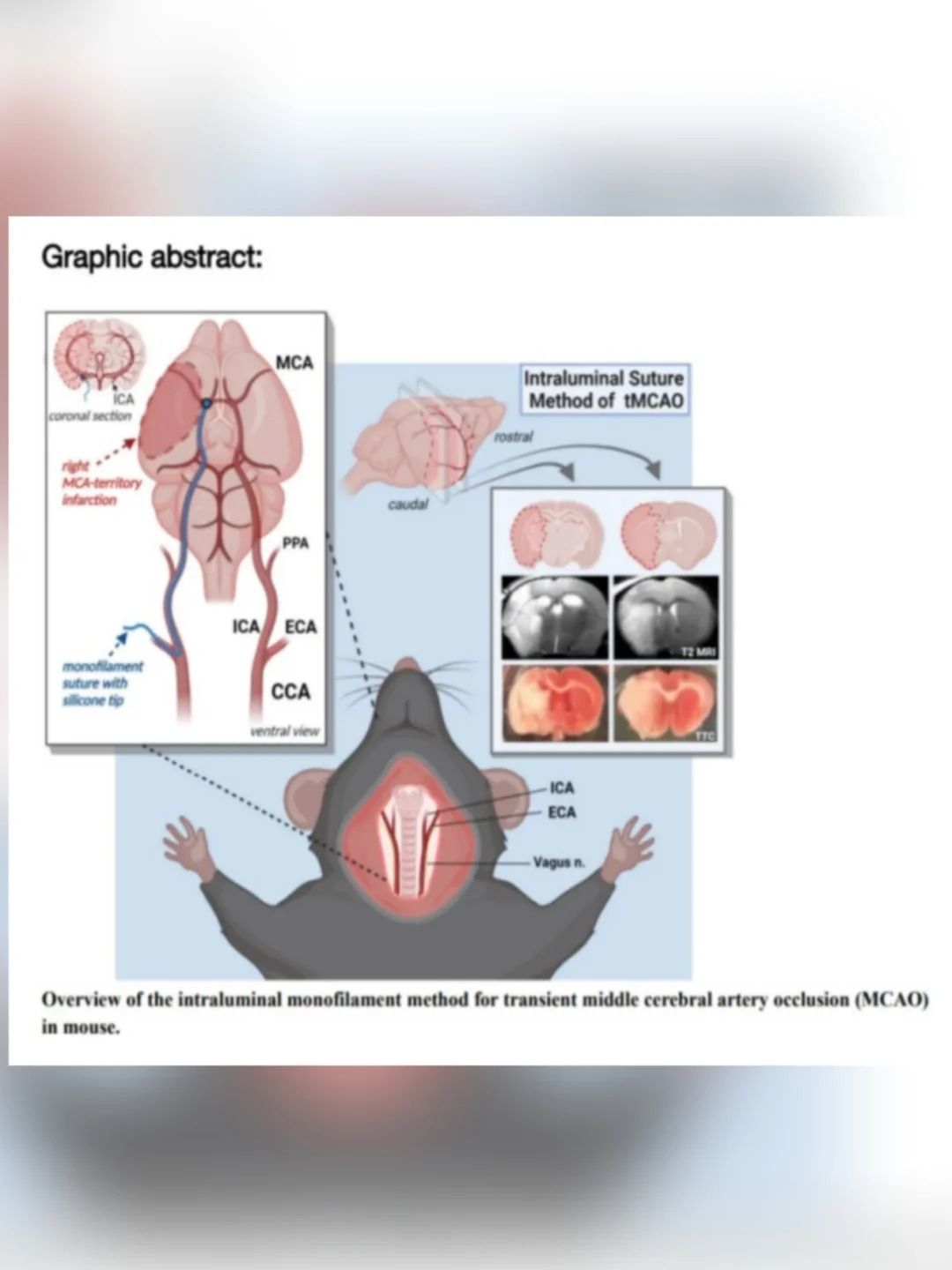
3. 再灌注操作
缺血时间控制:
短暂性缺血:通常60-90分钟
永久性缺血:不拔出线栓
再灌注技巧:
缓慢拔出线栓(约30秒)
观察ICA血流恢复(激光多普勒确认)
三、提高模型稳定性的关键技巧
1. 血流监测标准化
激光多普勒使用要点:
探头固定于颅骨(前囟后2mm,右侧3mm)
基线血流记录≥10分钟
成功标准:血流下降>70%基线
2. 生理参数控制
核心指标:
体温维持(37±0.5℃)
血氧饱和度(>95%)
动脉血气(pH 7.35-7.45)
血糖(4-8mmol/L)
3. 线栓选择与处理
线栓直径:
●大鼠:0.28-0.30mm
●小鼠:0.20-0.22mm
●硅胶头端处理:
长度:大鼠0.3-0.4mm,小鼠0.2-0.3mm
烘烤固化(60℃,24h)
四、质量控制与评估标准
1. 模型成功标准
急性期评估(24h):
神经功能评分≥2分(Bederson评分)
TTC染色梗死体积>20%同侧半球
2.排除标准:
蛛网膜下腔出血
术中死亡
未达到血流下降标准
2. 常见问题解决方案
问题
①高死亡率 线栓插入过深 调整插入深度,术前训练
②梗死体积变异大 体温波动 加强术中体温监控
③再灌注失败 血栓形成 优化肝素用量,线栓硅胶化处理
④神经评分不一致 评估主观性 采用盲法,多人评分
五、术后护理与长期观察
1. 术后管理要点
镇痛处理:布托啡诺(0.1mg/kg,sc)
补液支持:生理盐水(2ml,sc)
饮食调整:软食喂养3天
2. 长期观察指标
行为学测试时间窗:
急性期:1-3天
亚急性期:7-14天
慢性期:28天
推荐测试:
改良神经严重程度评分(mNSS)
转角试验
足失误测试
六、模型验证与优化建议
1. 多模态验证
影像学验证:
MRI(DWI序列检测早期缺血)
PET(代谢活性评估)
分子水平验证:
缺血半暗带标志物(HIF-1α)
凋亡相关蛋白(Caspase-3)
2. 技术创新方向
光化学诱导法:更精确的梗死定位
内皮素-1模型:无创诱导
微创技术:血管内介入法
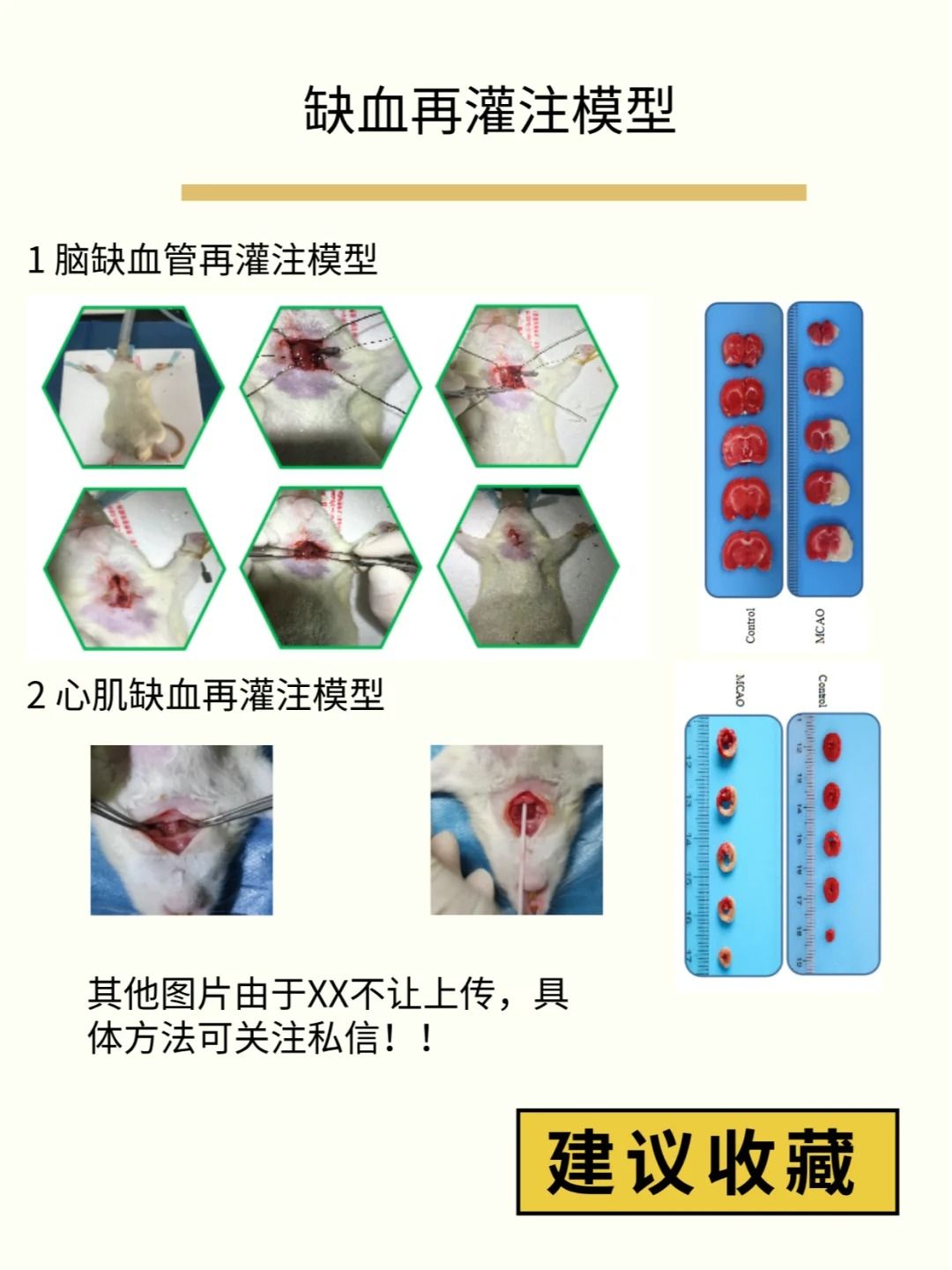
建立稳定的脑缺血再灌注损伤模型需要精细的手术操作、严格的参数控制和系统的质量评估。通过标准化操作流程和关键技巧的应用,可显著提高模型的成功率和可重复性,为脑卒中研究提供可靠的工具。
好啦,稳定的脑缺血再灌注损伤模型咱们就介绍完啦,如果您也对脑缺血再灌注损伤模型感兴趣或正在准备脑缺血再灌注损伤模型的话欢迎随时咨询普拉特泽生物、或者手动扫码~

