

原核表达载体和真核表达系统及其载体
 2024-11-12 16:55:19
2024-11-12 16:55:19
来源/作者:普拉特泽-生物医学整体课题外包平台
在讲原核和真核载体之前呀,我们需要先开了解一下原核表达系统和真核表达系统。上个视频中我们说了表达载体的表达其实就是转录和翻译,再具体一点呢就是指将外源基因(即非载体本身所固有的基因)导入到细胞(真核或者原核细胞)中,并使其在该细胞内进行转录和翻译,从而合成出相应的蛋白质或RNA分子。目前生物学上常见的蛋白表达系统有原核、酵母、昆虫、植物和哺乳动物表达系统,其中后面四类(酵母、昆虫、植物和哺乳动物)都为真核表达系统。接下来咱们就进入正题吧。
一、原核表达体系
首先先看看原核表达系统。原核表达系统包括枯草芽孢杆菌表达系统、链霉菌表达系统和大肠杆菌表达系统等,其中大肠杆菌表达系统是最常用的原核表达系统。大肠杆菌具有遗传背景清楚、繁殖快、成本低、表达量高、表达产物容易纯化、稳定性好、抗污染能力强以及适用范围广等特点,并且很容易使用热休克等方法转染。在各种表达系统中,最早被采用进行研究的也是大肠杆菌表达系统,且大肠杆菌表达系统以其细胞繁殖快速产量高、IPTG诱导表达相对简便等优点使其成为生产重组蛋白的最常用的系统。
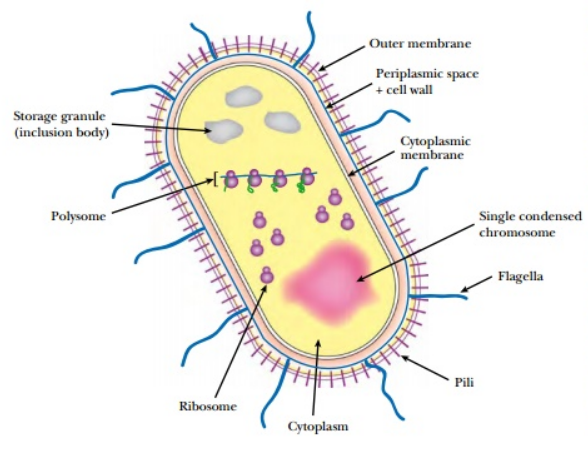
图一、原核细胞结构
对于表达不同的蛋白,需要采用不同的载体。已知的大肠杆菌的表达载体可分为非融合型表达载体和融合型表达载体两种。
1. 融合表达是将目的蛋白或多肽与另一个蛋白质或多肽片段的DNA序列融合并在菌体内表达。融合型表达的载体包括分泌表达载体、带纯化标签的表达载体、表面呈现表达载体、带伴侣的表达载体。
2. 非融合表达是将外源基因插入到表达载体强启动子和有效核糖体结合位点序列下游,以外源基因mRNA的AUG为起始翻译,表达产物在序列上与天然的目的蛋白一致。
常见的融合型原核表达载体有:pET系列(如上个视频中的pET-28a,还有pET-32a)、PGEX(如pGEX-4T和pGEX-6P-1等)系列和pMAL系列(pMAL-p2x和pMAL-c2X)等。以下面这个载体为例子,我们可以看到在多克隆位点的C端和N端各有一个6×His的标签,通过金属离子亲和层析技术(如镍柱亲和层析),可以方便地将带有6×His标签的重组蛋白从混合物中分离出来。His标签是多组氨酸标签,6×His标签因其组氨酸残基的序列可以在特定的缓冲液条件下结合到几种类型固定的离子上(如镍、钴和铜),从而具有高特异性和高结合能力。6×His标签的分子量相对较小,对目标蛋白的结构和功能影响较小,因此在后面的蛋白纯化中一般也不需要将该标签切除。这是pET系列载体普遍会带有的标签。
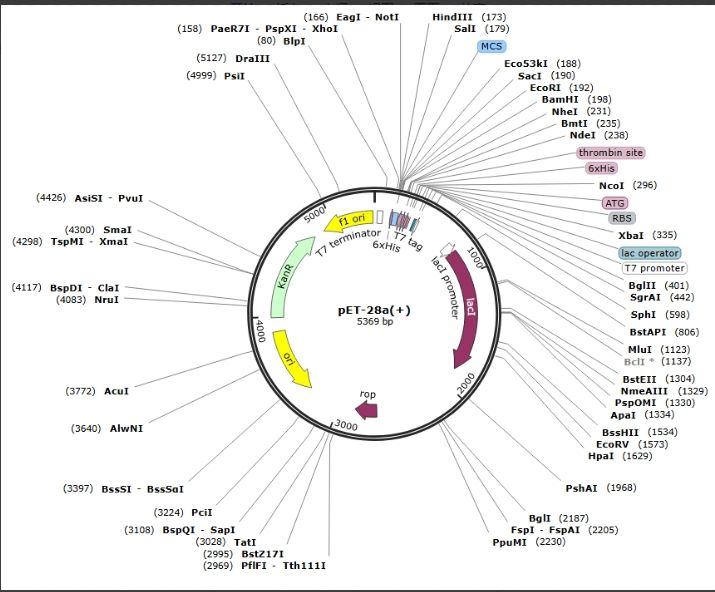
图二、融合型原核表达载体pET-28a
而pGEX -4T通常带有GST标签,GST标签是由谷胱甘肽S-转移酶的基因序列编码的一段多肽序列,。这段序列通常被融合到目标蛋白的N端或C端,用于后续的纯化和检测。通过利用谷胱甘肽与GST之间的强亲和力,可以使用谷胱甘肽琼脂糖凝胶等亲和层析材料将带有GST标签的蛋白从混合物中分离出来。GST标签表达出来的蛋白分子量比较大,有26KDa,如此大的蛋白质会影响我们目的蛋白的结构,因此在蛋白表达出来后我们需要使用相应的酶将GST标签切下来以得到只含有目的基因表达出来的蛋白。

图三、融合型原核表达载体pGEX-4T-1
常用的非融合型原核表达系统有:pKK223-3和pBV220系列等。下面以pBV220载体为例。按照定义我们可以得知,非融合型载体不需要带有标签,因此我们在载体中也就看不到相应的类似于His或者GST这类的标签,表达出来的蛋白就是只有目的蛋白,因此后续也不需要利用标签进行纯化。原核表达
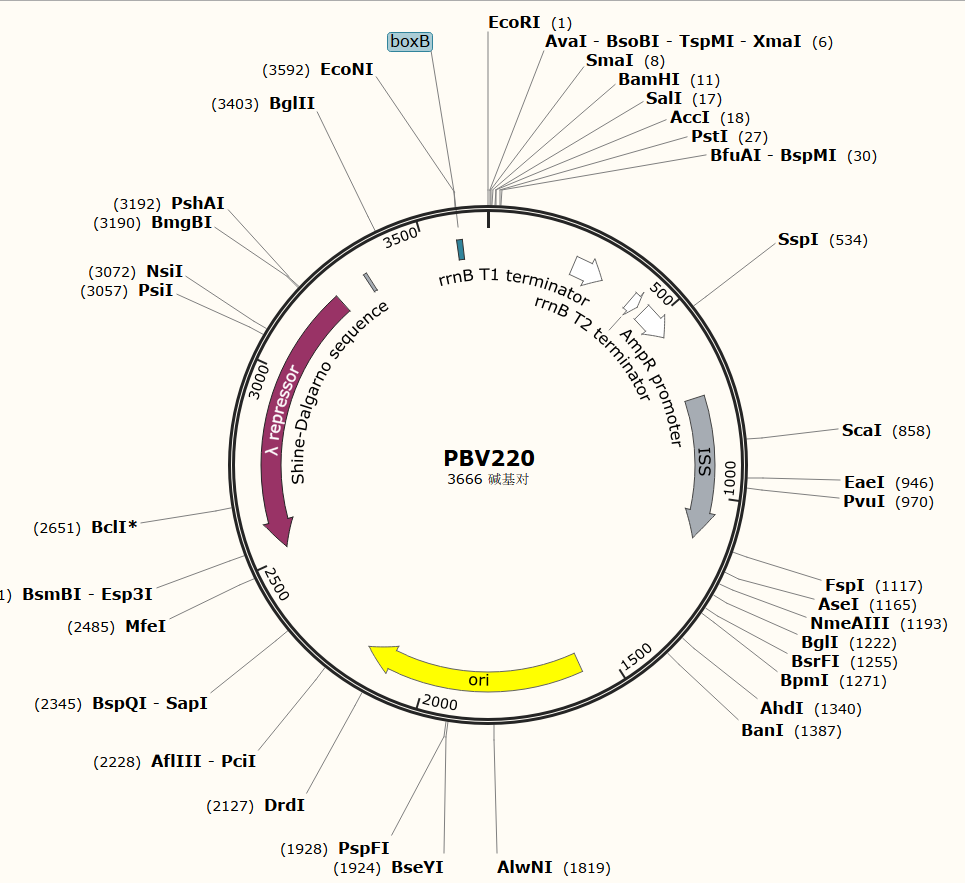
图四、非融合型原核表达载体pBV220
大肠杆菌表达体系通常适用于对于较少需要翻译后修饰的胞质蛋白,因为大肠杆菌蛋白质合成和修饰机制相对简单,缺乏真核生物中复杂的翻译后修饰系统,如糖基化、磷酸化等高级修饰过程,同时对于一些跨膜蛋白、糖蛋白以及和细胞膜结合的蛋白不太适合大肠杆菌的表达体系,因为大肠杆菌没有内质网等细胞器来促进蛋白结构的正确翻译折叠。因此,如果要表达真核生物的某些类型蛋白时,原核表达体系就失去了它的优势。那接下来就来看看真核表达体系。
二、真核表达体系
刚刚我们讲了,真核细胞进行蛋白质表达具有明显的优势,因为真核细胞不仅具有丰富的翻译后修饰机制,同时具有许多的细胞器(如内质网高尔基体等),能够产生具有提供天然结构的所有正确翻译后修饰的真核动物蛋白。因此,真核细胞进行重组蛋白制造的表达系统能够引入适当的蛋白质折叠、翻译后修饰和蛋白质组装,这对于蛋白质完整的生物活性是非常重要的。通常真核表达系统主要包括酵母、昆虫、植物和哺乳动物,下面我们就分别讲一讲常见的这四种真核生物表达体系以及各自代表性的载体。
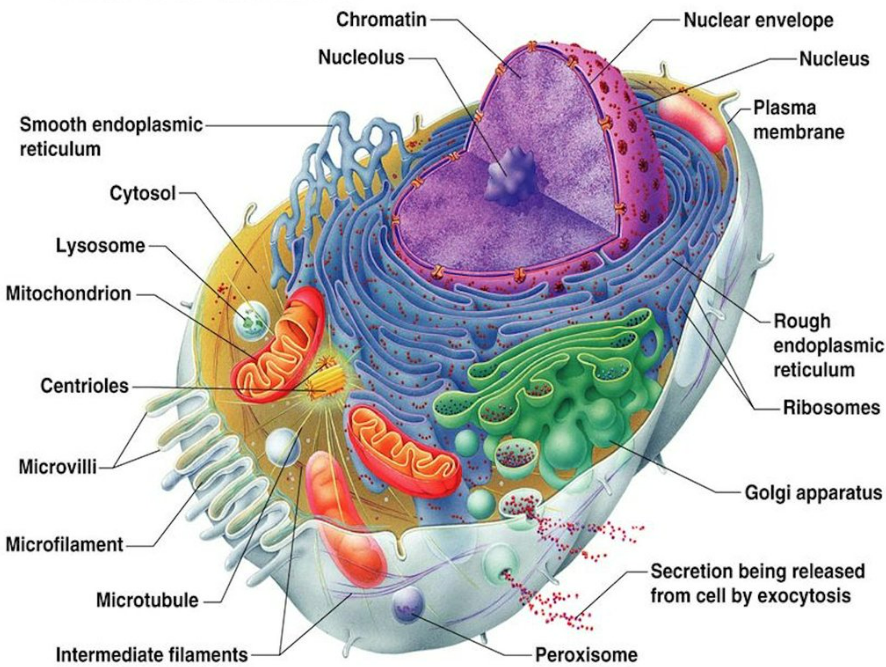
图五、真核细胞结构
(一)酵母表达系统
提到酵母,大家应该首先想到的是发酵,咱们吃的面包、酸奶、米酒这些都是需要经过发酵的。在分子生物学上,酵母是一种单细胞低等真核生物,培养条件普通,生长繁殖速度迅速,能够耐受较高的流体静压,用于表达基因工程产品时,可以大规模生产,有效降低了生产成本。酵母表达系统作为一种后起的外源蛋白表达系统,由于兼具原核和真核表达系统的优点,在基因工程领域中得到日益广泛的应用,应用此系统可高水平表达蛋白,且具有翻译后修饰功能,故被认可为一种表达大规模蛋白的强有力的工具。常用的酵母表达系统有酿酒酵母和甲醇营养型酵母。
1. 酿酒酵母表达系统:酿酒酵母在酿酒业和面包业的使用已有数千年的历史,它不产生毒素。酿酒酵母分为人造酿酒酵母和天然酿酒酵母。天然酿酒酵母具有16条染色体,其基因组包含大约1200万碱基对,分成16组染色体,共有6275个基因。这些染色体在细胞内以特定的方式排列和组合,维持着酵母细胞的正常生长和功能。而通过科学家的努力,特别是通过染色体融合技术的发明,人类成功创建了只有一条染色体的酿酒酵母菌株。这种人造酵母将原本分散在16条染色体上的所有遗传信息整合到了一条染色体上,但仍保持了与天然酵母相似的生长形态和功能。但是,酿酒酵母蛋白质表达量较低,易产生过量糖基化,转化子不稳定,易发生质粒丢失,因此目前应用最多的是甲醇型酵母。
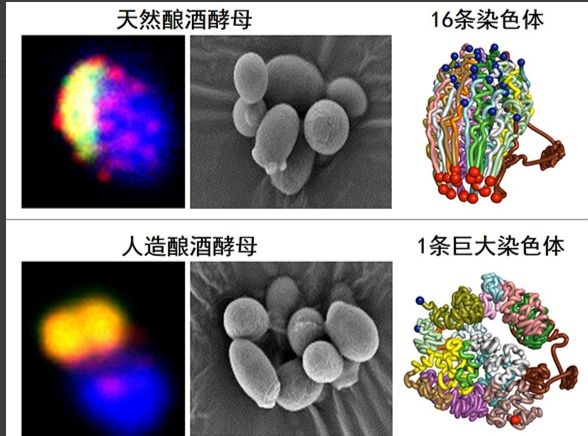
图六、人造酿酒酵母和天然酿酒酵母
2. 甲醇营养型酵母表达系统:甲醇酵母表达系统是目前应用最广泛的酵母表达系统。甲醇酵母主要有汉森酵母属,毕赤酵母属,球拟酵母属等,并以毕赤酵母属应用最多。甲醇酵母一般先在含甘油的培养基中生长。培养至高浓度。再以甲醇为碳源。诱导表达外源蛋白。这样可以大大提高表达产量。利用甲醇酵母表达外源性蛋白质其产量往往可达克级,与酿酒酵母相比其翻译后的加工更接近哺乳动物细胞,不会发生超糖基化。
了解完酵母表达体系的相关知识后,我们来看下酵母的表达载体。酵母表达载体指外源基因在酵母细胞中复制、扩增和表达的载体。甲醇酵母的表达载体为整合型质粒,载体中含有与酵母染色体中同源的序列,因而比较容易整合入酵母染色体中,大部分甲醇酵母的表达载体中都含有甲醇酵母醇氧化酶基因(AOX1),在该基因的启动子(PAOX1)作用下,外源基因得以表达。
甲醇酵母载体通常包括选择标记、调控序列。其中选择标记是载体转化酵母时筛选转化子所必须的元件,用于重组子的筛选和鉴定。选择标记可分为两类:
a. 营养缺陷型筛选标记:如HIS3,HIS4,LEU2,LYS2,TRP1,URA3等;(营养缺陷型筛选标记是指利用宿主为营养缺陷型,即该宿主细胞由于基因突变等原因无法合成某种生长所必需的营养物质(如氨基酸、维生素等),而我们目的质粒上则带有合成此物质的基因,在筛选过程中,将质粒导入宿主细胞,并置于不含该营养物质的培养基中。只有成功导入了质粒的宿主细胞,由于质粒上携带的合成该营养物质的基因得以表达,从而能够在该培养基上生长繁殖,形成可见的菌落或生长迹象。)
b. 抗生素筛选标记:氯霉素,G418,Zeocin等。(抗生素筛选标记则是利用质粒上携带的抗生素抗性基因来进行筛选的。这种抗性基因编码了一个蛋白质,使得细菌或宿主细胞对某种特定的抗生素具有耐药性,在筛选过程中,将质粒导入宿主细胞后,再将细胞置于含有该抗生素的培养基中。由于只有成功导入了带有抗生素抗性基因的质粒的细胞才能在含有抗生素的培养基中生存下来,因此可以通过观察培养基上的生长情况来筛选出成功导入了目标质粒的细胞。)
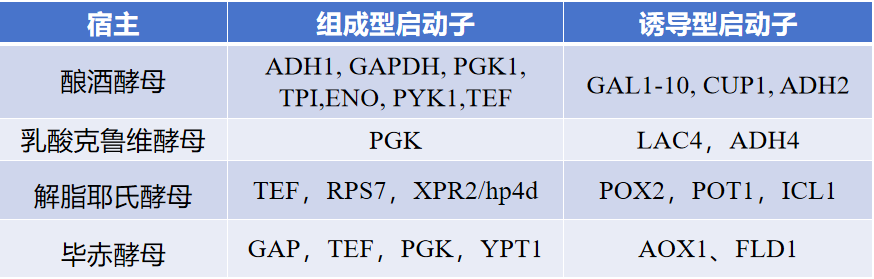
在酿酒酵母和乳酸克鲁维酵母中,LEU2基因和G418抗性基因是最常用,对于解脂耶氏酵母,主要使用LEU2和URA3基因。而在毕赤酵母中,最常使用的筛选标记是HIS4和zeocin。调控序列包括启动子、ARS(酵母复制起始区)等,其中启动子可分为两类(组成型启动子和诱导型启动子)。组成型启动子提供简单性和相对恒定的表达水平,而当需要分离生长和生产时通常使用诱导型启动子,这能防止无意中选择生长较快的非重组细胞或产生毒性蛋白。不同的受体细胞常用的启动子如表中所示。
在真核蛋白表达中用的最多的酵母表达系统是毕赤酵母表达系统,包括分泌型表达载体和非分泌型表达载体两种。那么这两种载体分别是什么呢?在基因工程中,分泌型表达载体在毕赤酵母中能够指导外源蛋白分泌到细胞外,非分泌型则用于在毕赤酵母细胞内表达外源蛋白,这些蛋白通常留在细胞内而不被分泌到细胞外,这类载体适用于那些需要在细胞内进行特定修饰或功能验证的蛋白质。分泌型表达载体和非分泌型表达载体的主要区别在于它们指导蛋白质表达的位置不同。分泌型表达载体将蛋白质分泌到细胞外,便于后续的分离纯化和应用;而非分泌型表达载体则将蛋白质留在细胞内,适用于细胞内功能研究或需要进一步细胞内加工的蛋白质。因此咱们可以根据实验的目的来选择载体的种类。
毕赤酵母分泌表达载体的一个典型例子是pPICZα 系列载体,该系列包含A、B和C载体。下图是pPICZα A的载体图谱,我们一个个元件来看:pPICZα A载体包含以下元素:AOX1 启动子(对相关基因进行严格调控,位于载体的5'端,是一个严格调控的启动子,能够利用甲醇诱导高效表达目的基因)、用于重组蛋白分泌的α-因子分泌信号(编码酿酒酵母α-因子分泌信号,该信号序列能够引导重组蛋白的分泌性表达。这段前导肽序列在蛋白质翻译过程中被合成,并作为信号肽引导新合成的蛋白质通过细胞膜的分泌途径。在分泌过程中,信号肽被特定的酶切割,而重组蛋白的其余部分则被释放到细胞外。)、BIeoR博来霉素抗性基因(用于大肠杆菌和毕赤酵母中的筛选,该基因的序列使得携带pPICZα A载体的细胞能够在含有博来霉素的培养基上生长)、标签的 C 端肽用于检测和纯化重组融合蛋白(包括Myc和His标签,这些标签位于目的基因的下游,用于重组蛋白的检测和纯化,同时Myc和His标签的序列是已知的,可以在蛋白质纯化过程中作为识别和结合的靶点)、AOX1转录终止子(位于载体的3'端,确保mRNA的正确终止,转录终止子序列包含特定的终止信号,如多聚腺苷酸化信号等,polyA尾巴是真核生物特有的,在也是成熟信使RNA的标志之一,也是咱们判断一个载体是不是真核载体的一个标准)。

图七、毕赤酵母分泌型载体pPICZαA
毕赤酵母非分泌型表达载体的一个典型例子是pGAPZ 系列,该系列包含A,B,和C载体,都使用GAP启动子在毕赤酵母中稳定表达重组蛋白。GAP启动子的重组蛋白表达水平略高于AOX1启动子。同时也含有BIeoR博来霉素抗性基因,该载体同样带有Myc和His标签,后续可以对表达的蛋白进行纯化。其实大部分的结构元件跟上面那个载体一样,其中最大的区别在于分泌型载体上带有的α-因子分泌信号在非分泌型载体上不存在,这也是分泌型载体之所以叫分泌型载体的原因。
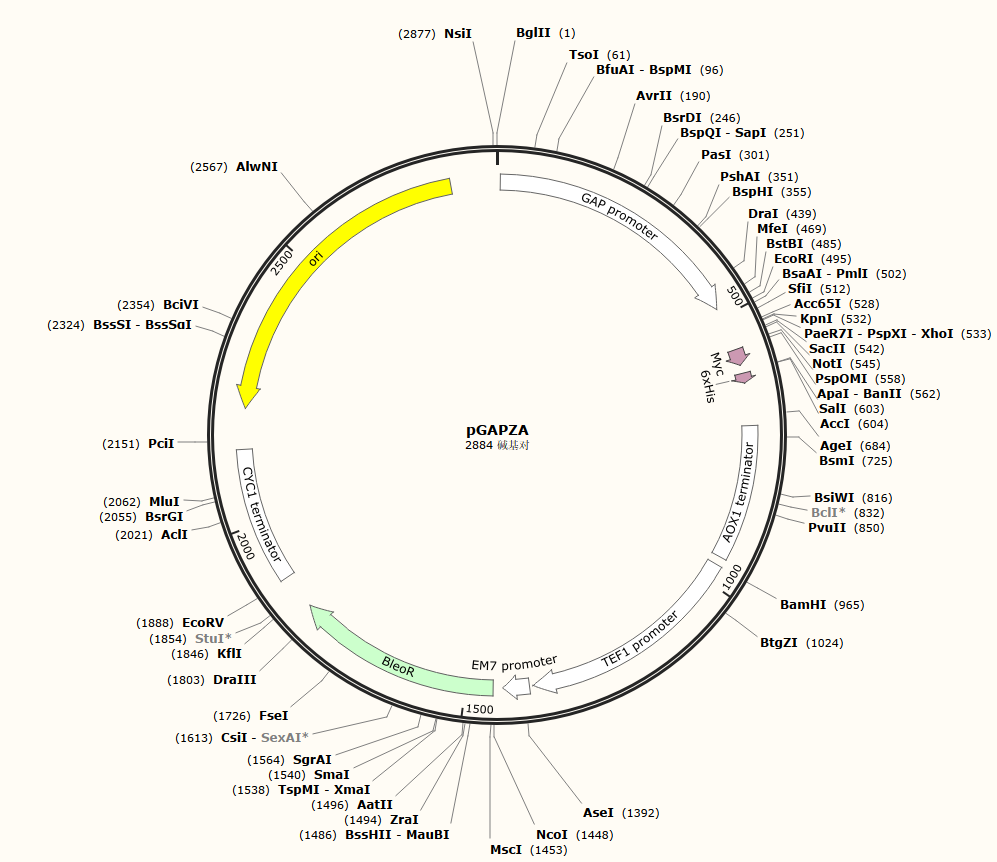
图八、毕赤酵母非分泌型载体pGAPZ A
(二)昆虫表达系统
昆虫表达系统是一类应用广泛的真核表达系统,它具有同大多数高等真核生物相似的翻译后修饰加工以及转移外源蛋白的能力。昆虫表达系统的原理主要基于杆状病毒的特性。什么叫杆状病毒呢?杆状病毒是一类闭合环状双链病毒,以昆虫为主要宿主。通过将目标蛋白质编码序列克隆至合适的杆状病毒转移载体上,目的基因与杆状病毒的基因组通过同源重组或转座作用制备重组病毒DNA。随后,该重组病毒DNA感染昆虫细胞或虫体,外源基因随着病毒的复制而产生重组蛋白质。
昆虫表达系统具有真核表达系统的翻译后加工功能,如二硫键的形成、糖基化及磷酸化等,使重组蛋白在结构和功能上更接近天然蛋白;其最高表达量可达昆虫细胞蛋白总量的50%;可表达非常大的外源性蛋白(可达200kD);具有在同一个感染昆虫细胞内同时表达多个外源基因的能力;对脊椎动物是安全的。由于病毒多角体蛋白在病毒总蛋白中的含量非常高,至今已有很多外源基因在此蛋白的强大启动子作用下获得高效表达。
常见的昆虫杆状病毒表达系统包括Bac-to-Bac表达系统和MultiBac表达系统。
Bac-to-Bac表达系统:根据 F 因子载体原理,用类似于酵母体内重组的方法,构建了一种杆状病毒穿梭载体Bacmid。常用的载体为pFastBac载体该载体可像质粒一样在大肠杆菌中生长,又对鳞翅目昆虫细胞具有感染性。Bacmid含有 F 因子复制子( 可在大肠杆菌中复制) 、卡那霉素抗性基因,同时包含Tn7转座元件,这是一种能够将目的基因通过转座方式整合到大肠杆菌Bacmid质粒上特定位点的元件(转座是指DNA序列在基因组中从一个位置移动到另一个位置的过程,这个过程涉及到DNA序列的复制(在某些类型的转座中)和随后在基因组新位置的插入。转座是生物体内一种重要的遗传变异机制,能够导致基因组的重排和基因表达的调控变化。转座子则是执行转座过程的DNA序列),这一特性使得pFastBac载体能够方便地与Bacmid穿梭载体结合,进而在昆虫细胞中产生重组病毒。
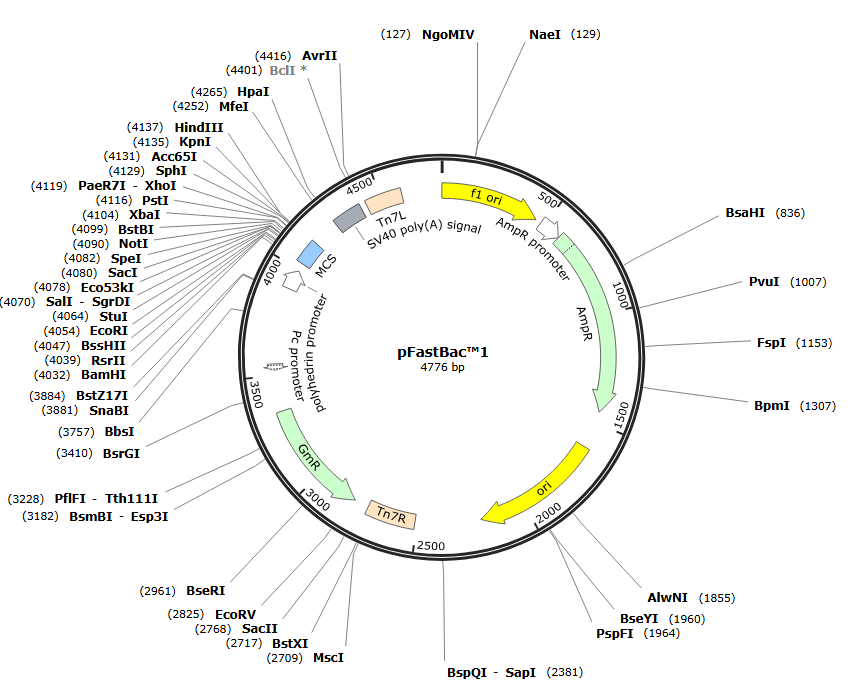
图九、昆虫系统表达载体pFastBac
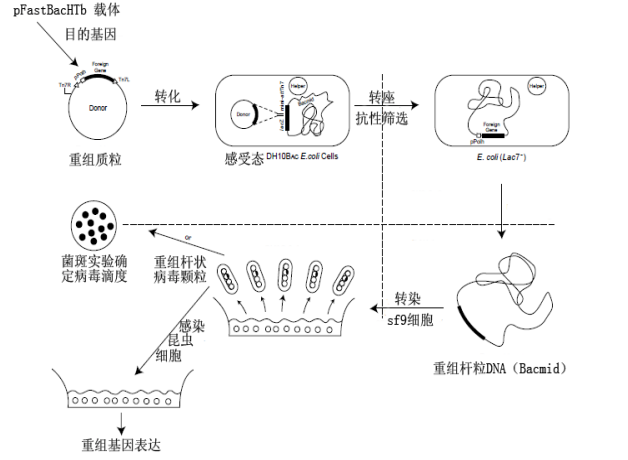
图十、Bac-to-Bac系统 pFastBac载体构建流程
MultiBac表达系统:MultiBac是一种先进的杆状病毒/昆虫细胞系统,已被开发并用于生产具有许多亚基的多蛋白复合物,用于学术和工业研究与开发。MultiBac由针对蛋白质复合物生产进行优化的工程杆状病毒组成。这种MultiBac杆状病毒基因组以大肠杆菌中的细菌人工染色体(BAC)存在。它包含两个外源基因整合位点,通过Tn7,或者通过Cre酶介导的位点特异性重组。MultiBac进一步由一系列质粒组成,这些质粒称为受体和供体,可促进多基因组装。MultiBac杆状病毒(中心)是通过在昆虫细胞中转染复合MultiBac BAC产生的。MultiBac已成功用于基础和应用研究与开发中的各种应用程序。目的基因显示为白色箭头。红色圆圈表示LoxP。复制起点显示为矩形。
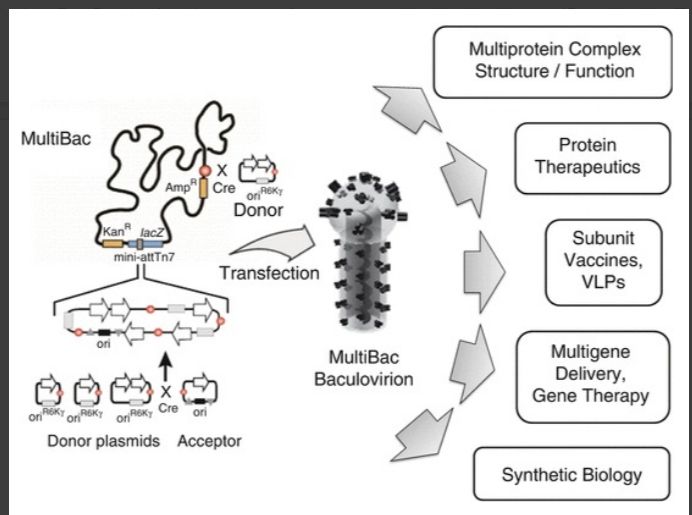
图十一、MultiBacc系统载体构建流程
(三)哺乳动物表达系统
哺乳动物细胞表达外源重组蛋白可利用质粒转染和病毒载体的感染。利用质粒转染获得稳定的转染细胞需几周甚至几个月时间,而利用病毒表达系统则可快速感染细胞,在几天内使外源基因整合到病毒载体中,尤其适用于从大量表达产物中检测出目的蛋白。根据目的蛋白表达的时空差异,可将哺乳动物的表达系统分为瞬时、稳定和诱导表达系统。
1. 瞬时表达系统是指宿主细胞在导入表达载体后不经选择培养,载体DNA随细胞分裂而逐渐丢失,目的蛋白的表达时限短暂;瞬时表达系统的优点是简捷,实验周期短。
2. 稳定表达系统是指载体进入宿主细胞并经选择培养,载体DNA稳定存在于细胞内,目的蛋白的表达持久、稳定。由于需抗性选择甚至加压扩增等步骤,稳定表达相对耗时耗力。
3. 诱导表达系统是指目的基因的转录受外源小分子诱导后才得以开放。采用异源启动子、增强子和可扩增的遗传标记,可提高蛋白产量。
哺乳动物表达系统在蛋白的起始信号、加工、分泌、糖基化方面具有独特优势,适合表达完整的大分子蛋白。由哺乳动物细胞翻译后再加工修饰产生的外源蛋白质,在活性方面远胜于原核表达系统及酵母、昆虫细胞等真核表达系统,更接近于天然蛋白质,但构成复杂、操作技术要求高、表达产量不大、产率低,且有时会导致病毒感染等是该表达系统的不足之处。
哺乳动物细胞表达载体必须包含原核序列、启动子、增强子、选择标记基因、终止子和多聚核苷酸信号等控制元件。接下来一起来看看具体的元件及其功能。
1.原核序列中包括:原核复制子、抗生素抗性基因及多克隆位点。
2.启动子(分为两类):病毒来源:SV40(绿猴空泡病毒)、CMV(巨细胞病毒)、RSV(肉瘤病毒)、ADV(腺病毒)、LTR(逆转录病毒长末端重复序列);细胞来源:HSP(热休克蛋白)等。
3.增强子:有些含有增强子。常用增强子:SV40 enhancer、CMV enhancer、RSV enhancer、LTR enhancer。
4.终止信号和poly A信号:功能是使转录后的mRNA能有效进行切割和加上polyA尾巴也就是多聚腺苷化,poly A增加mRNA的的稳定性。
5.选择标记基因:胸苷激酶基因(tk)、二氢叶酸还原酶基因 (dhfr)、新霉素抗性基因(neo)和氯霉素乙酰转移酶基因(cat) 。
哺乳动物细胞表达载体类型分为两类:非病毒载体(质粒)和病毒载体(腺病毒、逆转录病毒、腺相关病毒)等。
(1)非病毒载体:由真核复制信号、启动子、转录单位以及质粒片段组成,不需要包装细胞,比如pSV系列、pCDNA3等。接下来介绍一下常用的pcDNA3载体。pcDNA3载体可用于在多种哺乳动物细胞系中实现高水平、组成型表达。包含可选标记物和多克隆位点,具有以下特点:具备高水平表达蛋白的巨细胞病毒(CMV)增强子启动子;正向 (+) 或反向 (-) 的大分子多克隆位点;牛生长激素(BGH)多聚腺苷酸化信号和转录终止序列用于增强mRNA稳定性;氨苄青霉素耐药基因和pUC复制区序列用于大肠杆菌中的选择和维持。
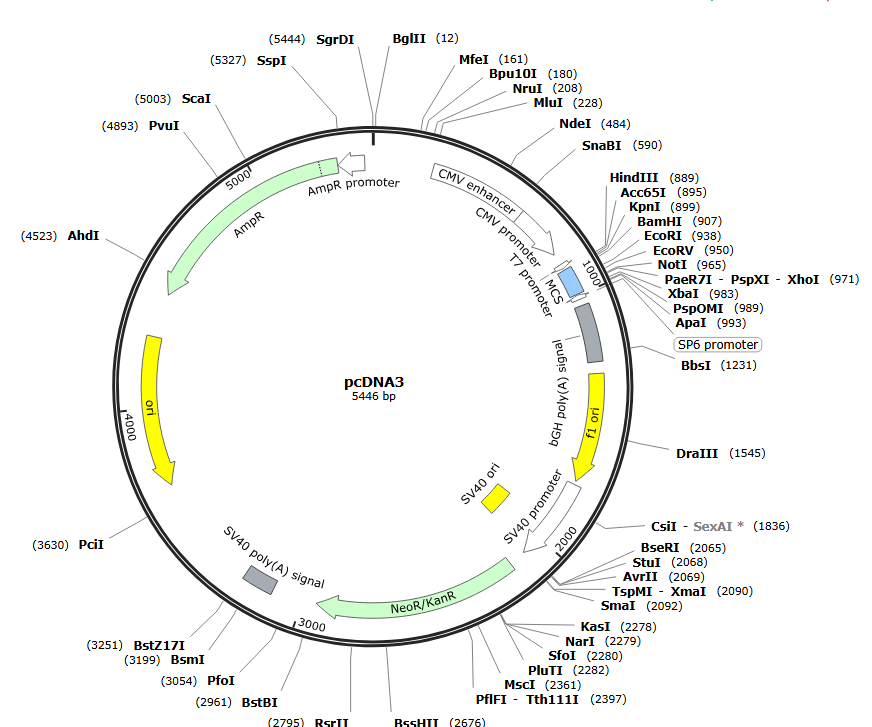
图十二、哺乳动物非病毒载体pcDNA3
(2)病毒型载体:病毒型载体的类型分为两类,即整合型和游离型。整合型:整合入宿主染色体随染色体复制而复制,可持续表达外源基因;安全性低,可能会整合到基因编码区导致插入诱变。如:慢病毒载体等。游离型:不整合、生物安全性高、瞬时表达。如腺病毒载体。下图展示了慢病毒和腺病毒的载体图谱。那我们该如何来分辨一个载体是整合型的还是非整合型的,虽然载体图谱本身可能不直接标注“整合型”或“非整合型”的字样,但通过分析图谱中的信息,我们可以间接推断出载体的类型。整合型病毒载体(如慢病毒)的图谱中可能会包含病毒整合酶基因(如HIV-1中的IN基因)的相关片段,这些基因对于病毒整合到宿主基因组中是必需的,非整合型病毒载体(如腺病毒)的图谱中则较少或不会包含这类与整合相关的病毒结构基因。同时还有一些特殊的表达元件,如慢病毒载体上带有的cPPT(来自HIV-1整合酶基因)和WPRE(来自土拨鼠肝炎病毒的转录后调节元件),这些元件有助于增加病毒在宿主基因组的拷贝数和转基因的表达效率,腺病毒则不会带有这些,
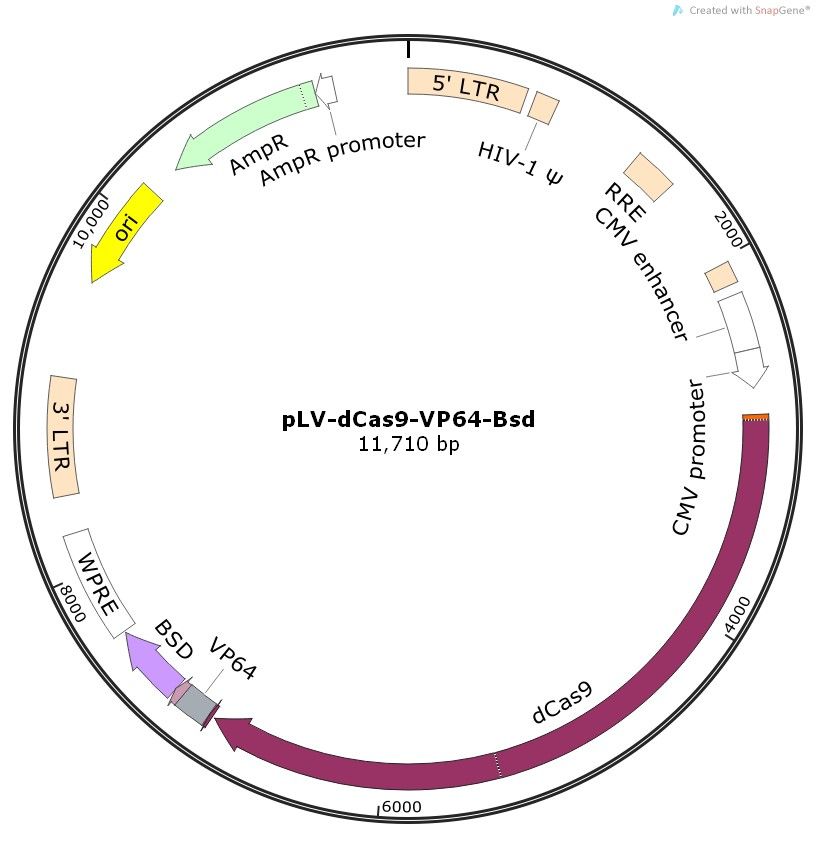
图十三、整合型慢病毒载体和非整合型腺病毒载体
(四)植物表达系统
植物表达系统基于植物细胞的遗传转化能力,通过构建含有目标基因的表达载体,将其导入植物细胞或组织,并利用植物体内的基因表达调控机制实现目标基因的高效表达。这一过程通常包括载体的构建、转化植物细胞、筛选和鉴定转化体以及目标基因的表达和功能分析等步骤。下图展示了利用农杆菌侵染法将目的基因导入到马铃薯中的流程,在这里就不展开讲述了。
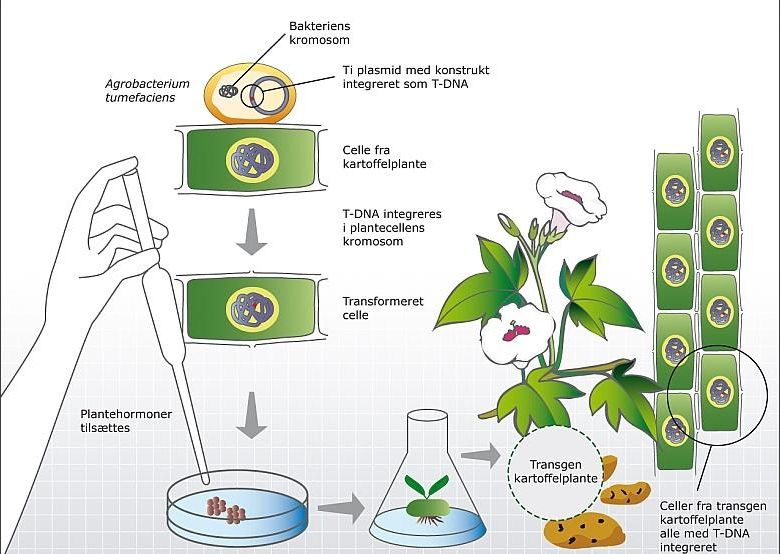
图十四、植物表达系统构建过程
好了,讲了这么多,大家估计脑子里是一团乱麻,下表给大家汇总了各种表达体系的特点及其优缺点,有需要的小伙伴可以自行截图保存。本期内容就到这结束了,跪求大家一键三连呀,下期咱们讲讲真核
视频版本观看请点击《从零开始学基因工程:揭秘“载体”,让小白也能轻松掌握》

还可以加入实验技术交流群和师姐们一起交流哦

