

细胞铁死亡信号通路
 2024-11-26 11:40:49
2024-11-26 11:40:49
来源/作者:普拉特泽-生物医学整体课题外包平台
今天普拉特泽生物给大家讲述一些
细胞铁死亡信号通路
首先给大家详细介绍下其原理
——细胞铁死亡(ferroptosis)是一种新型的程序性细胞死亡方式,其特征是铁的积累和脂质过氧化,导致产生反应性氧化物(ROS)并进而引起细胞损伤。自2012年由Stockwell的研究团队正式提出以来,铁死亡已成为生物医学研究的热点。
本文将深入探讨细胞铁死亡的主要机制及其信号通路。
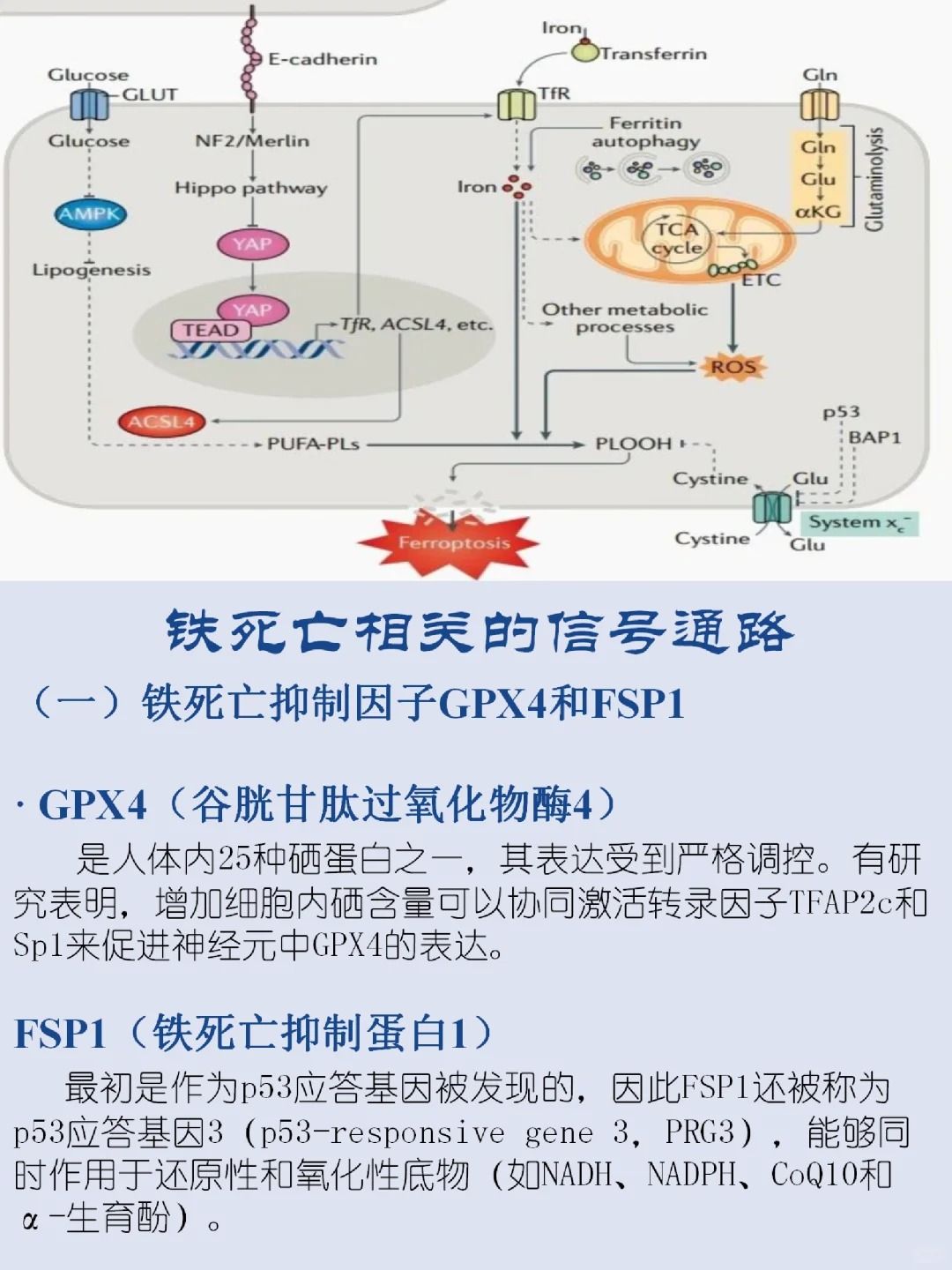
〖一〗铁死亡的主要机制
铁死亡的发生依赖于细胞内铁的累积和脂质过氧化物的积累。铁离子,特别是二价铁离子,在酯氧合酶的作用下,可以催化细胞膜上高表达的不饱和脂肪酸发生脂质过氧化,从而诱导细胞死亡。此外,铁死亡还表现为抗氧化体系(谷胱甘肽GSH和谷胱甘肽过氧化物酶4-GPX4)的表达量降低。
GPX4是脂质过氧化过程的抑制蛋白,能够降解小分子过氧化物以及相对复杂的脂质过氧化物。当GPX4的活性降低时,脂质过氧化反应增加,脂质活性氧增多,最终导致铁死亡。
〖二〗铁死亡的信号通路
铁死亡的信号通路复杂多样,主要包括以下几个方面:
▲胱氨酸/谷氨酸反向转运体系:
胱氨酸/谷氨酸反向转运体系(System xc-)是细胞获取胱氨酸的主要途径,而胱氨酸是合成谷胱甘肽的重要前体。小分子erastin通过抑制System xc-,降低了细胞对胱氨酸的获取,导致谷胱甘肽合成受阻,进而引发膜脂ROS的积累和铁死亡。
▲p53基因:
p53是重要的抑癌基因,能够通过调节细胞胱氨酸代谢以及ROS应答,介导铁死亡过程。激活p53基因后,细胞抗氧化能力显著降低,对铁死亡更敏感。此外,p53还能通过下调System xc-的关键成分SLC7A11的表达,抑制胱氨酸的吸收,进一步降低细胞抗氧化能力,促进铁死亡的发生。
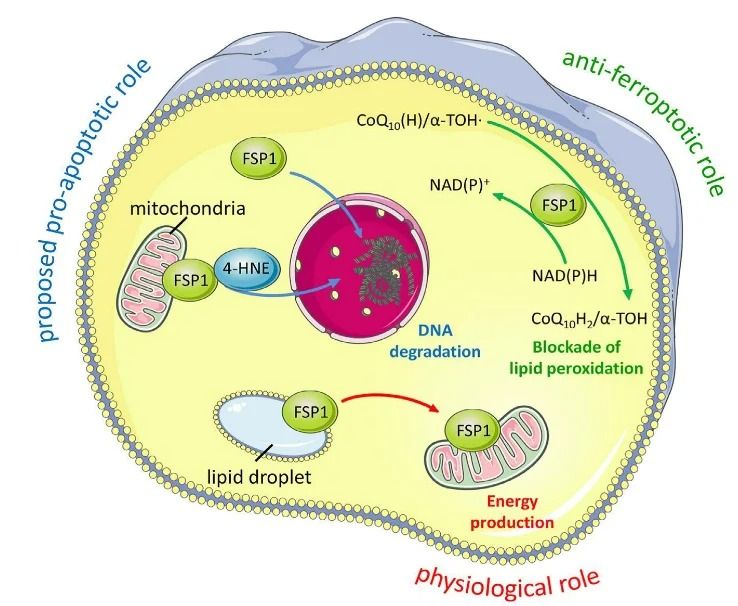
▲谷胱甘肽过氧化物酶(GPX4):
GPX4是铁死亡过程中的关键酶,其活性降低直接导致脂质过氧化反应增加。多种化合物,如RSL3、DPI7和DPI10等,能够直接作用于GPX4,抑制其活性,从而引发铁死亡。此外,甲羟戊酸通路(MVA通路)通过调节硒代半胱氨酸tRNA的成熟,影响GPX4的活性,也是铁死亡的重要调节通路。
▲电压依赖性阴离子通道(VDACs):
VDACs是转运离子和代谢产物的跨膜通道,参与铁死亡的调节。Erastin可以作用于VDACs,引起线粒体功能紊乱,氧化性物质释放,最终导致细胞氧化性死亡。虽然VDAC2和VDAC3是铁死亡的必要非充分条件,但它们的表达变化对细胞对铁死亡的敏感性有显著影响。
▲铁代谢和脂质代谢:
铁代谢是决定细胞命运的关键因素之一。游离在细胞中的亚铁离子与过氧化氢发生芬顿反应,催化羟基自由基的生成,并催化脂质过氧化反应,加速铁死亡的发生。脂质代谢则通过控制磷脂过氧化来调节铁死亡。多不饱和脂肪酸在氧化应激下特别容易发生脂质过氧化,是铁死亡的主要原因之一。
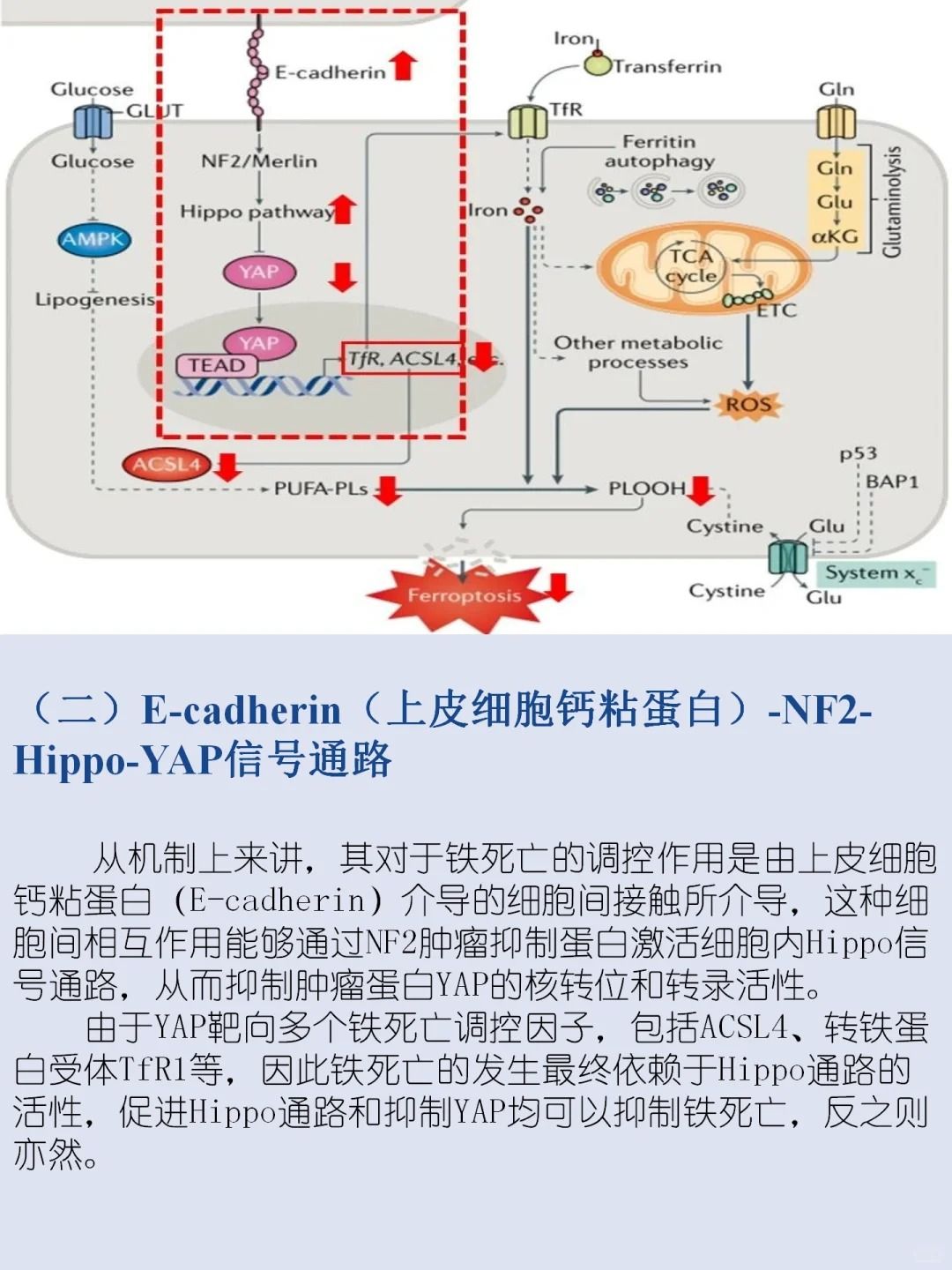
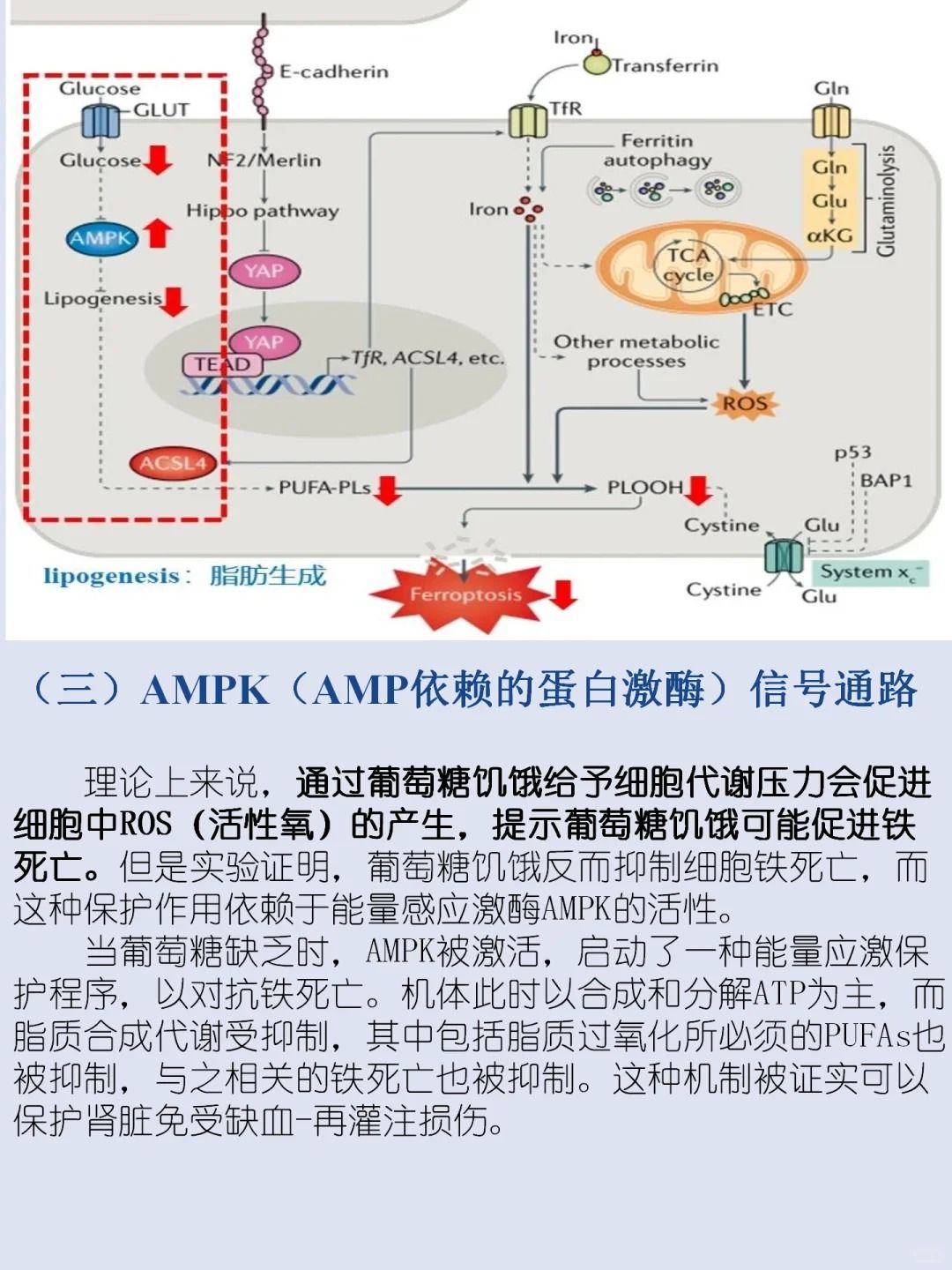

▲铁死亡与疾病的关系
铁死亡与多种生理和病理过程相关,包括癌症进展、神经退行性疾病、组织损伤和缺血再灌注损伤等。在癌症治疗中,铁死亡能够选择性诱导某些类型的癌细胞死亡,具有作为治疗癌症的潜力。
同时,铁死亡也参与神经退行性疾病如帕金森病、阿尔茨海默病的发病过程。
结论
细胞铁死亡是一种独特的程序性细胞死亡方式,其发生机制复杂多样,涉及多种信号通路的调节。通过深入研究铁死亡的信号通路,可以为相关疾病的治疗提供新的靶点和思路。
随着生物医学与技术手段的不断进步,相信未来会有更多关于铁死亡的新机制被发现和应用。

冰冻三尺,非一日之寒,普拉特泽致力于帮助广大科研工作者解决细胞铁死亡等课题服务中各方面问题,不但授人以鱼,亦授人以渔。

