

细胞衰老的检测方法,你都了解吗?
 2022-07-20 16:57:40
2022-07-20 16:57:40
来源/作者:普拉特泽-生物医学整体课题外包平台
今天普拉特泽生物跟大家一起学习的是细胞衰老的检测方法。细胞衰老时,细胞的各种结构呈退行性变化,根据其特征,我们常用于检测衰老的方法主要是β-半乳糖苷酶活性检测和端粒长度的检查两个,我们来一个一个看:
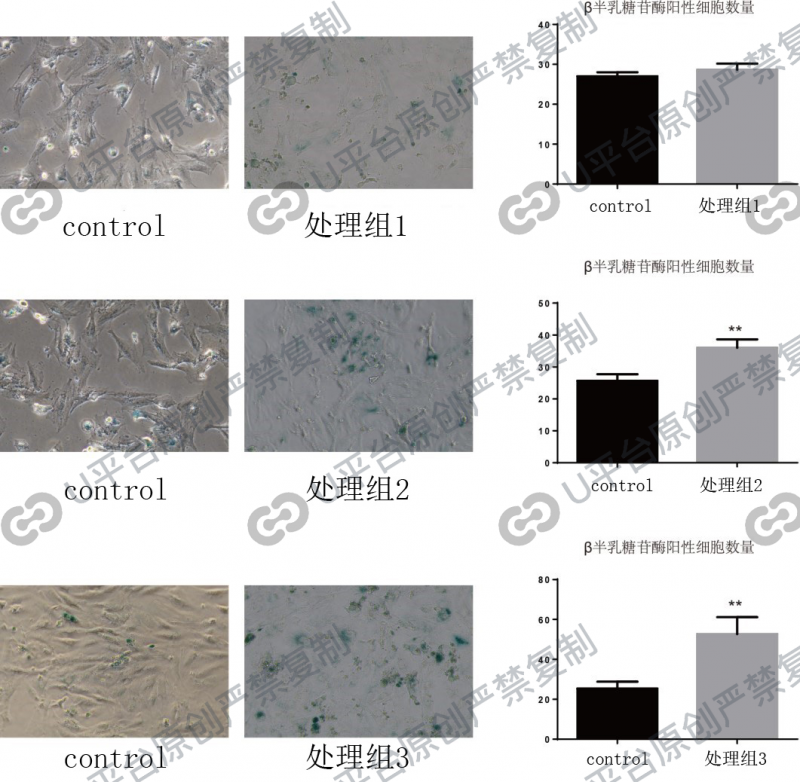
一、β-半乳糖苷酶活性测定
1995年,Dimiri等发现体外培养二倍体成纤维细胞在培养基pH值为6时,其β-半乳糖苷酶染色的阳性率随代龄增加而逐渐上调,他们把这种中性β-半到糖苷酶定义为SAβ-gal,即衰老相关的β-半到糖荷酶,衰老细胞或组织产生的β-半乳糖苷酶可以催化底物X-Gal,生成深蓝色产物,从而在光学显微镜下很容易观察到。在人体表皮角质层细胞中,也可以发现SA-β-gal随年龄的增加而增加。并目,SA-β-gal不依赖干DNA复制,可以区分衰老细胞与静止期的细胞。
SA-β-gal是一种体内体外都适用的检测衰老的生物标记物。由于检测SA-β-gal的方法简单易行,其在检测衰老细胞方面有很广泛的应用。
二、端粒长度的检查
端粒是位于真核细胞染色体末端顶部的核蛋白结构,由高度保守的TTAGGG 重复序列组成,其存在可以保护染色体末端,是维持染色体稳定的重要因素。鉴于端粒的特殊结构,端粒的长度会随着每次细胞的分裂而缩短,因此,端粒长度是衰老的一个重要生物标志。这里我们主要讨论端粒限制性片段(TRF)分析及荧光原位杂交(FISH)法。
首先是端粒限制性片段分析:TRF分析也称作端粒的Southern印迹法,是应用针对端粒重复序列的探针来检测限制性酶切后所保留的端粒的方法。限制性酶会将基因组DNA消化为短的片段,留下大量完好的端粒,即所谓的端粒限制性片段。以凝胶电泳分离基因组片段,通过放射性探针(CCCTAA)。杂交“TTAGGG”重复序列的方式可以检测到端粒的存在。鉴于细胞的异质性,TRFs的大小不一,反映出细胞中端粒长度的不同。TRF分析对试剂和仪带无特殊要求,因此这种方法目前有看较为广泛的应用,但它存在一些缺陷,TRE分析测量的是整个样品端粒长度的平均值,由于不同端粒的长度相差很大,这种方法既不能分辨单个端粒也不能分辨单个细胞内端粒的平均长度。鉴于短端粒在电泳迁移中不集中且杂交信号弱,这种方法很难检测到在衰老研究中尤为重要的短端粒。另外,这种方法还存在操作复杂,所需样品量大等缺陷,相比之下,FISH技术样品用量小直观、敏感,可以检测染色体问端粒长度的变化。
荧光原位杂交:FISH端粒长度分析基于荧光肽核酸探针(PNA)的特导性标记。PNA探针是DNA同源的合成肽链,其中DNA带负电的磷酸戊糖骨架被不带由的N-2胺乙基甘氨酸骨架所取代,这样的修饰产生了非常稳定高效的针对靶DNA 的特异性杂交。PNA探针发出的荧光信号与所杂交的端粒长度直接相关,因此这种方法可用于测量端粒的长度,FISH不但可以应用于单细胞水平的单个染色体端粒长度的测量,还可应用于组织匀浆及组织切片。
OK!那关于细胞衰老实验检测的方法我们就学习到这里啦,如果您也有自己的想法或者需要细胞衰老实验外包的需求欢迎随时给我们留言!

