

Transwell迁移实验报告【新人必看】
 2024-02-28 11:46:16
2024-02-28 11:46:16
来源/作者:普拉特泽-生物医学整体课题外包平台
Transwell迁移实验报告由普拉特泽生物给大家解答与分享,普拉特泽生物细胞检测可承接各种细胞外包服务,包括CCK8/mtt/细胞增殖检测、原代细胞分离培养与鉴定、细胞周期等实验外包服务,本文继续给大家带来关于Transwell迁移实验报告,快来收藏吧!
一、实验目的
通过Transwell实验检测Hela细胞转染CDC20-sgRNA3或SP600125处理后其迁移能力的变化。
二、实验样品及分组
1.实验样本

备注:包括干预细胞用的相关试剂均按实验样品登记,每行登记一个或一组独立样品
2. 实验分组
细胞:Hela
分组:sgRNA-NC、CDC20-sgRNA3
处理:Con(0.1% DMSO)、SP600125处理(20 μM,48h)
三、实验结果
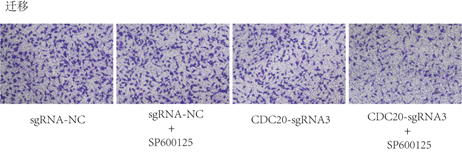
各组侵袭实验结果图(100×)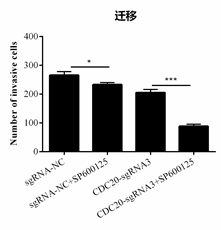
各组迁移实验结果柱形图(迁移数)
四、实验材料
1. 主要实验仪器

五、实验原理
阳离子脂质体表面带正电荷,能与核酸的磷酸根通过静电作用,将DNA分子包裹入内,形成DNA脂复合物,也能被表面带负电的细胞膜吸附,再通过融合或细胞内吞进入细胞。脂质体转染适用于把DNA转染入悬浮或贴壁培养细胞中,是目前实验室最方便的转染方法之一,其转染率较高,优于磷酸钙法;由于脂质体对细胞有一定的毒性,所以转染时间一般不超过24小时。
迁移:Transwell小室上室种肿瘤细胞,下室加入FBS或某些特定的趋化因子,肿瘤细胞会向营养成分高的下室跑,计数进入下室的细胞量可反映肿瘤细胞的迁移能力
六、实验步骤
1.细胞复苏
(1) 将ddH2O预温至37℃。
(2) 戴上手套和口罩帽子,从液氮罐中取出装有目的细胞的冻存管(内有1 mL细胞混合液),立即投入37℃ ddH2O中,轻摇冻存管使之在1分钟内快速溶解。
(3) 完全溶解后,75%酒精擦拭冻存管外壁消毒后带进超净台。
(4) 在超净台中,在15 mL灭菌离心管中预先加入10 mL新鲜配制的培养基,打开冻存管,将所有冻融的细胞悬液加入该离心管中,常温1000 rpm离心3分钟,吸除上层的培养液。
(5) 1mL培养基重悬细胞沉淀,轻轻吹打混匀后加入T25细胞培养瓶中,补足培养基至5 mL,置于37℃、5% CO2培养箱培养。
(6) 48小时后换液,细胞融合接近80%时即可传代。
2. 细胞培养
Hela细胞用含10%胎牛血清、1%双抗的DMEM培养基在37℃饱和湿度、含5%CO2的孵箱中培养。
3. 细胞转染及收样
(1) 铺板:处于对数生长期的目的细胞,胰蛋白酶消化成单细胞悬液,按实验需要接种于6孔板(2×105个细胞/孔),根据细胞大小和形状调整接板细胞量。
(2) 培养:37℃、5%CO2培养箱中过夜培养,待细胞长至50%~60%汇合度进行转染。
(3) 质粒和脂质体准备:用125μL不含血清的培养基孵育4μg目的片段;125μL不含血清的培养基孵育8μL Lipo汉恒,静置5min;将含质粒和含有脂质体的培养基混合,混匀后室温静置20min。
(4) 弃去板中原有培养基,把混合液加入到细胞培养板中;4~6h后换成完全培养基。
(5) 继续培养24-48h。
4. 迁移实验
(1) 胰酶消化收集状态良好的目的细胞(已转染),制成单细胞悬液(无血清培养基配置,药物处理组含药物);上室加200μL已调节好细胞密度的细胞悬液(7×103个);下室加500μL全培养基(小室外,24孔板孔内;药物处理组含药物)。
(2) 于37℃、5% CO2细胞培养箱培养相应时间;
(3) 用4%多聚甲醛室温固定20 min,用棉签轻柔擦拭以去除小室内未迁移过去的细胞,注意操作以免刺穿底层聚碳酸酯膜;
(4) 在新的24孔板孔中加500μL结晶紫,室温染色10 min;
(5) 用PBS冲洗掉小室上多余的染料,置于空气中晾干;
(6) 100倍显微镜拍照,再用PS计数,计算各孔穿过膜的细胞数量。
今天关于Transwell迁移实验报告就分享到这儿啦~如果您在实验过程中遇到技术问题,或者需要实验外包和代做,可与我们技术老师联系18570028002(微信同号)

