

Masson(马松)染色操作步骤与结果分析【附视频教程】
 2022-03-02 14:45:38
2022-03-02 14:45:38
来源/作者:普拉特泽-病理染色技术平台
Masson三色染色又称马松染色,是显示组织中纤维的主要方法之一。普拉特泽生物承接Masson(马松)染色等病理染色相关服务上万例,积累了操作大量经验,为大家详细分享马松染色的实验操作步骤与染色结果分析,同时为广大科研工作者开展线上的理论培训与线下实操,可承接染色实验外包服务。
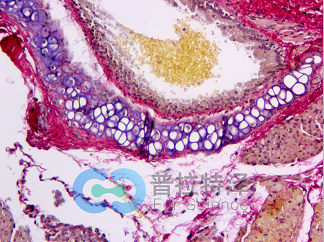
Masson染色法是结缔组织染色中最经典的一种方法,其原理与阴离子染料分子的大小和组织的渗透有关,分子的大小由分子量来体现,小分子量易穿透结构致密、渗透性低的组织;而大分子量则只能进入结构疏松的、渗透性高的组织。然而,淡绿或苯胺蓝的分子量都很大,因此Masson染色后肌纤维呈红色,胶原纤维呈绿色或蓝色,主要用于区分胶原纤维和肌纤维。
传统的马松染色使用四种染料,使组织切片呈现三种颜色,准确的称呼是马松三色染色法(Masson's trichrome stain)。第一种染料是苏木精,配制成Weigert氏铁苏木精液,与HE染色相似,这里的苏木精也是染细胞核,由于用的是铁苏木精,细胞核染色后不是经典HE染色的蓝色,而是呈现暗灰黑色,这是第一色。第二种染料酸性品红和第三种染料丽春红配制成混合溶液,这两种红色染料染与HE染色中的伊红相似,可以染细胞质为红色,这是第二色。第四种染料是甲基蓝(苯胺蓝也可),染胶原纤维为蓝色,这是第三色。经典的马松染色效果与HE染色对比如下图:
这是小鼠皮肤组织两种病理染色图片,左边是马松三色染色,右边是HE染色。
右边HE染色呈现蓝色和红色两种颜色,而左边马松三色染色有灰黑色、红色和蓝色三种颜色,尤为明显的是蓝色。左图中的大片蓝色区域是皮肤上皮组织,结构较为疏松,含有较多的胶原纤维,被马松三色染色法中的甲基蓝染成蓝色。这样染色后,可以清晰地看到毛孔在上皮结蹄组织中的分布。因此,被染成蓝色的细胞外基质(通常都含有胶原纤维)就能和细胞以及其他组织形成鲜明的对比,从而易于观察。在某些病理状态,如心肌梗死,肝硬化和肾纤维化等情况下,病变的细胞会被结缔组织取代,用马松染色能很好地发现病变部位,并能对病变进行定量的评估。因此,直到今天,马松染色依然是组织学和病理学中活跃的染色方法,并出现了几种改良的马松染色,使得染色效果更加理想。
Masson(马松)染色实验操作试剂准备:
1、Regaud 氏苏木精:苏木精1g,95%酒精10 ml,甘油10 ml,蒸馏水8 0ml,将苏木精加入蒸馏水内加温溶解,冷却后加入酒精和甘油,放数日后即可应用。
2、Masson丽春红酸性复红液: 丽春红0.7g,酸性复红0.3g,蒸馏水99 ml,冰醋酸1ml。
3、0.2%冰醋酸水溶液: 冰醋酸0.2 ml,蒸馏水100 ml。
4、1%磷钼酸水溶液:磷钼酸1g,蒸馏水100 ml。
5、苯胺蓝水溶液:苯胺蓝2g,蒸馏水98 ml,冰醋酸2 ml。
6、1%光绿水溶液:光绿 1g,蒸馏水100 ml。
Masson(马松)三色法染色实验操作步骤:
1. 石蜡切片脱蜡至水。
2. 铬化处理或去汞盐沉淀(甲醛固定的组织此步可略)。
3. 依次自来水和蒸馏水洗。
4. 用Regaud苏木精染液或Weigert苏木精液染核5-10 min。
5. 充分水洗,如过染可盐酸酒精分化。
6. 蒸馏水洗。
7. 用Masson 丽春红酸性复红液5-10 min。
8. 以2%冰醋酸水溶液浸洗片刻。
9. 1%磷钼酸水溶液分化3-5 min。
10. 不经水洗,直接用苯胺蓝或光绿液染5 min。
11.以0.2%冰醋酸水溶液浸洗片刻。
12.95%酒精、无水酒精、二甲苯透明、中性树胶封固。
Masson染色预期结果:胶原纤维、粘液、软骨呈蓝色(如光绿液染色为绿色),胞浆、肌肉、纤维素、神经胶质呈红色,核黑蓝色。
OK!那么Masson染色的实验操作过程与结果分析我们就分享到这里啦,想学习更详细的实验操作步骤的同学欢迎点击我们的春风学院——《Masson染色实操》专栏继续学习哦,当然如果您有Masson染色实验外包的需求,普拉特泽随时在在线任君采撷哦!

