

甲苯胺蓝染色步骤
 2025-02-12 17:32:25
2025-02-12 17:32:25
来源/作者:普拉特泽-生物医学整体课题外包平台
甲苯胺蓝染色步骤由普拉特泽生物病理实验平台为大家总结分享。普拉特泽生物为广大科研人员提供长期稳定的番红固绿染色外包实验服务
本文给大家分享咱们技术长期总结下来的动物组织番红固绿组织染色实验步骤:
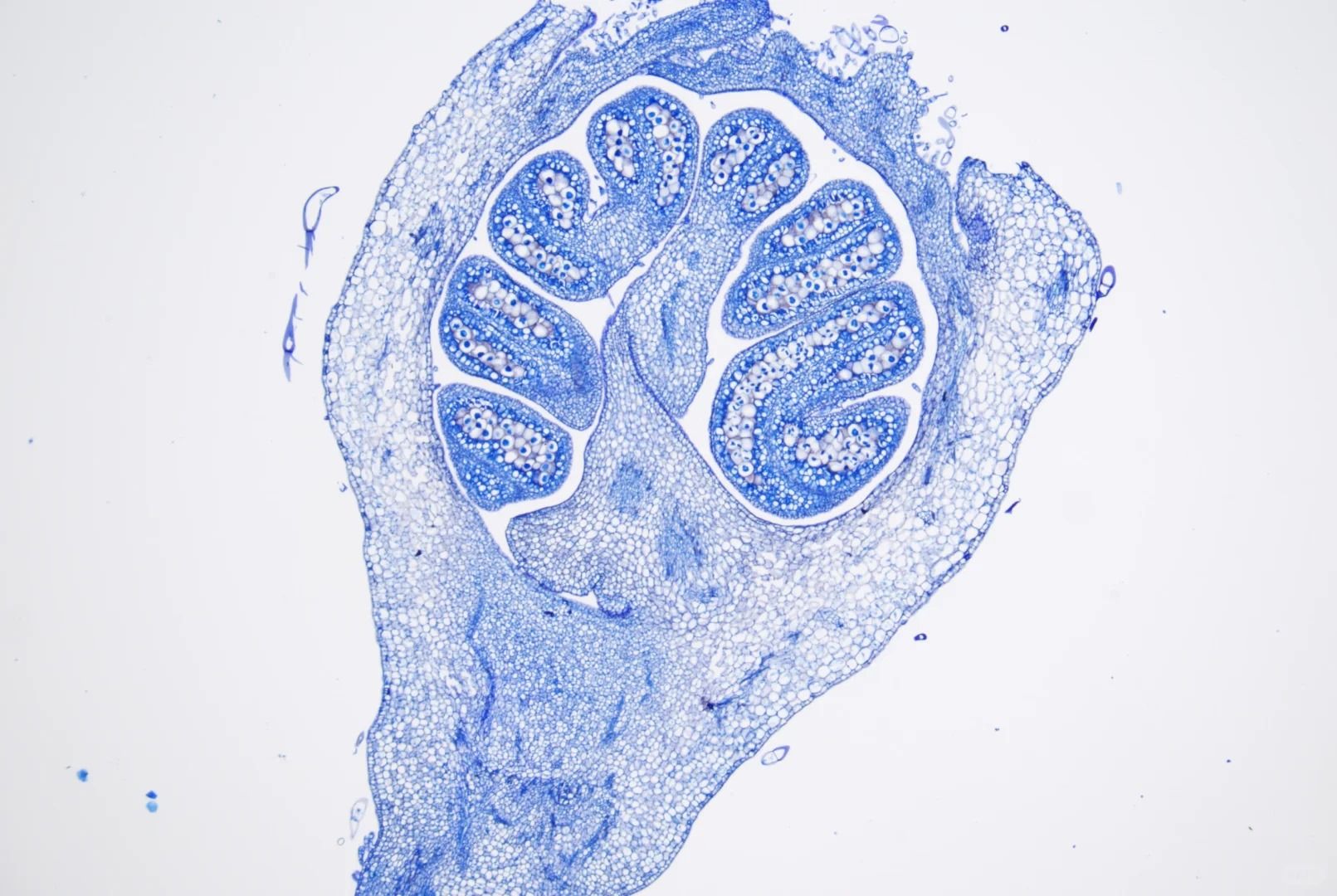
甲苯胺蓝染色在组织学和细胞学实验中可是个重头戏,它能帮助我们清晰地观察到细胞的结构和成分。
一、准备阶段
⒈获取待染色的组织标本,这可以是活体组织或已经固定的组织切片。
⒉将组织标本进行固定,常用的固定剂有10%缓冲福尔马林溶液或4%的缓冲乙醛溶液。固定时间根据组织的大小和类型而定,一般为数小时至过夜。
二、脱水与渗透
Step1:将固定后的组织标本进行脱水处理,常用的脱水剂为乙醇。脱水过程中,逐渐将组织标本从低浓度的乙醇转移到高浓度的乙醇中,直至完全脱水。
Step2:将脱水后的组织标本进行渗透处理,常用的渗透剂为二甲苯。将组织标本逐渐转移到二甲苯中,确保组织完全渗透。
包埋与切片
Step3:将渗透后的组织标本进行包埋处理,常用的包埋剂为石蜡。
Step4:将包埋后的组织标本进行切片,切片厚度一般为4~6微米。切片工具常用的是组织切片机。
1)脱蜡至水
Step5:将切片放入二甲苯中浸泡脱蜡,一般需要经过三个二甲苯缸,每个缸浸泡5~10分钟。
Step6:使用无水乙醇、95%乙醇和75%乙醇依次浸泡切片,每个浓度浸泡1分钟左右,目的是去除切片上的二甲苯,并使切片逐渐水化。
用自来水冲洗切片数秒,洗去残留的乙醇。

2)染色
Step7:将切片放入甲苯胺蓝染色液中,染色时间通常为20~30分钟。具体时间可根据实验需求和切片情况适当调整。
Step8:在染色过程中,要确保切片完全浸泡在染色液中,并轻轻摇动染色缸,使染色更加均匀。

3)分化
Step9:染色完成后,使用95%乙醇或1%盐酸酒精进行分化,去除多余的染料。分化过程中要在显微镜下观察切片,控制分化效果。分化时间不宜过长,避免过度分化导致染色过浅。
脱水透明
Step10:将分化后的切片再次放入无水乙醇中脱水,确保切片上的水分被完全去除。
Step11:将脱水后的切片放入二甲苯中进行透明处理,一般需要经过三个二甲苯缸,每个缸浸泡1~2分钟。透明过程中要确保切片完全浸泡在二甲苯中,使切片变得透明清晰。


4)封片与观察
Step12:在石蜡切片的中央滴加一滴中性树胶,然后盖上盖玻片进行封固。封片时要避免产生气泡,以免影响观察效果。
Step13:封片完成后,将切片放在显微镜下观察。在显微镜下,你可以清晰地看到细胞核被染成蓝色,肥大细胞等特定细胞结构也呈现出独特的染色效果。


怎么样?甲苯胺蓝的染色步骤是不是既详细又清晰呢?只要按照上述步骤操作,你就能轻松掌握这项技术啦:18570028002(甲苯胺蓝的染色实验指导)
记得在实验过程中要注意安全哦!

