

这是我见过的WB结果图最多的文章!【文献解读】
 2020-12-17 15:53:24
2020-12-17 15:53:24
来源/作者:普拉特泽生物-医学整体课题外包

这篇发表于Nat Commun( IF:11.8780)杂志上的文章将WB实验从头贯彻到尾,研究黑色素瘤细胞中ITCH/BRAF/MEK/ERK通路。
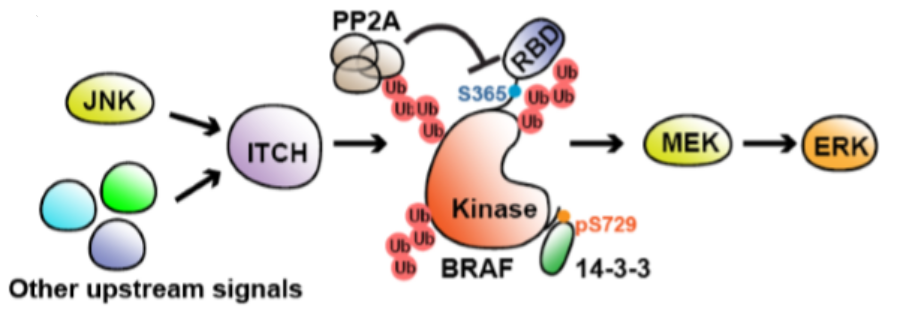
本文结论:在黑色素瘤细胞中,受到细胞因子的刺激,BRAF主要通过K27位点被多聚泛素化,且不导致最终的蛋白降解。这种非典型的泛素化作用是由ITCH E3连接酶响应c-Jun-N-末端激酶(JNK)介导的磷酸化作用而催化的。K27位点的BRAF泛素化消除了14–3–3介导的BRAF激酶活性抑制,导致BRAF / MEK / ERK信号得以维持,进而有助于肿瘤细胞因子促进黑色素瘤细胞的存活。
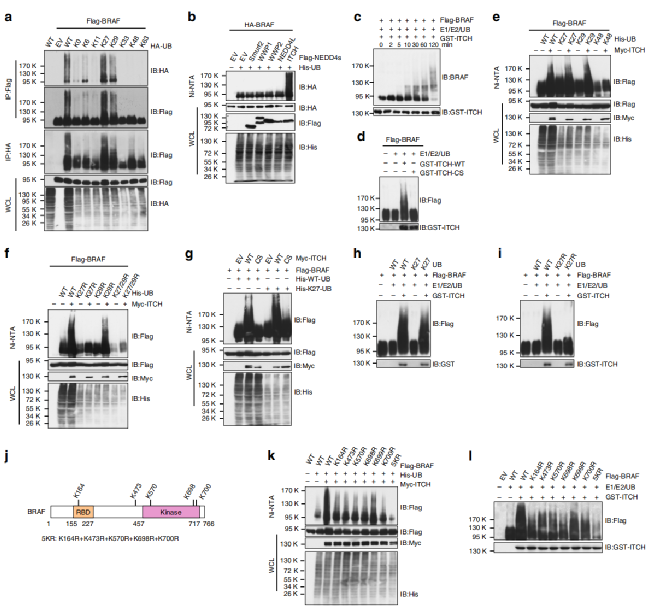
Fig 1. ITCH通过K27位点使BRAF泛素化
黑色素瘤细胞中,内源性BRAF的多泛素化。为了确定BRAF蛋白上的多聚泛素化位点,作者构建了BRAF单泛素化位点突变体,结果显示,在K27位点存在的情况下泛素化水平最高(a)。之后用多种K27位点相关泛素化连接酶处理,其中ITCH显著增强了BRAF的泛素化水平(b)。那么ITCH是否是通过K27位点对BRAF位点进行泛素化的呢?共转染结果显示K27、K29位点存在的情况下,BRAF的泛素化水平均显著增加(e)。将K27、K29位点分别突变,发现K29位点突变后不影响ITCH的效果,综上结果表明ITCH是通过K27位点对BRAF位点进行泛素化(f-i)。
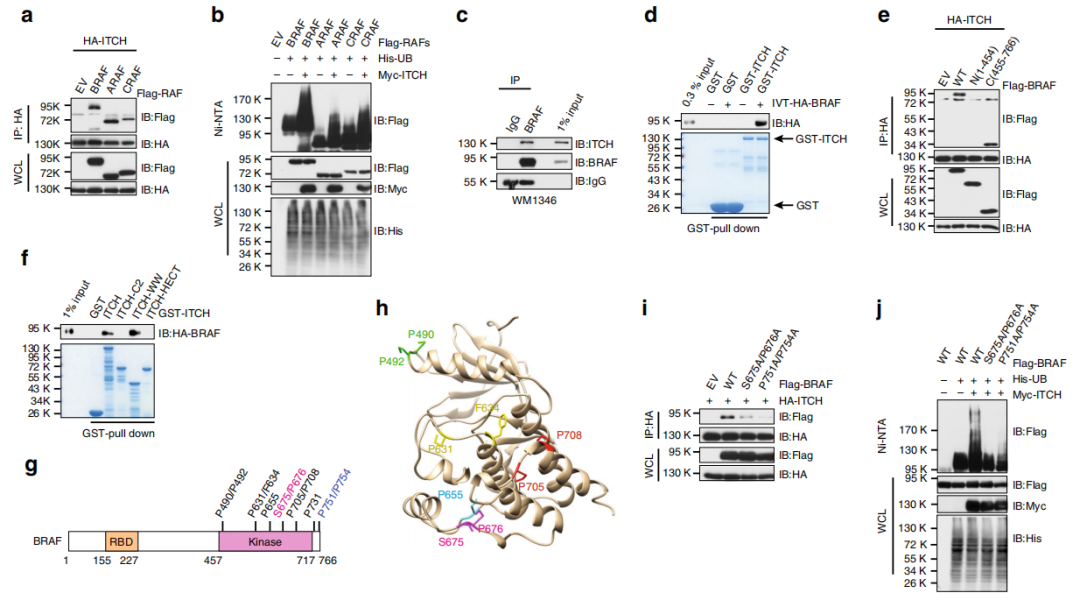
Fig 2. ITCH通过激酶结构域与BRAF相互作用
之后作者将重点放在阐明ITCH引起的BRAF泛素化如何决定黑色素瘤环境中的BRAF / MEK / ERK信号级联。GST pull down实验进一步证明了ITCH与BRAF直接互作(d)。作者发现BRAF的C末端激酶结构域直接与ITCH结合(e),ITCH利用其WW 结构域与BRAF互作(f)。在BRAF的激酶结构域中鉴定出许多非PPxY脯氨酸丰富的基序(g,h)。BRAF蛋白上S675/P676 或者P751/P754位点突变均可导致其与ITCH结合减少。总结以上结果,在BRAF激酶结构域中查明了两个富含脯氨酸的基序,这些基序介导了ITCH-BRAF相互作用,以促进BRAF的K27位点多泛素化。
备注:
1.NEDD4家族泛素E3连接酶(包括ITCH)通过其WW结构域与其底物相互作用。
2.除了PPxY基序,NEDD4家族E3连接酶还通过其他富含脯氨酸的基序(例如PPLP,pSP或pTP基序)募集底物。
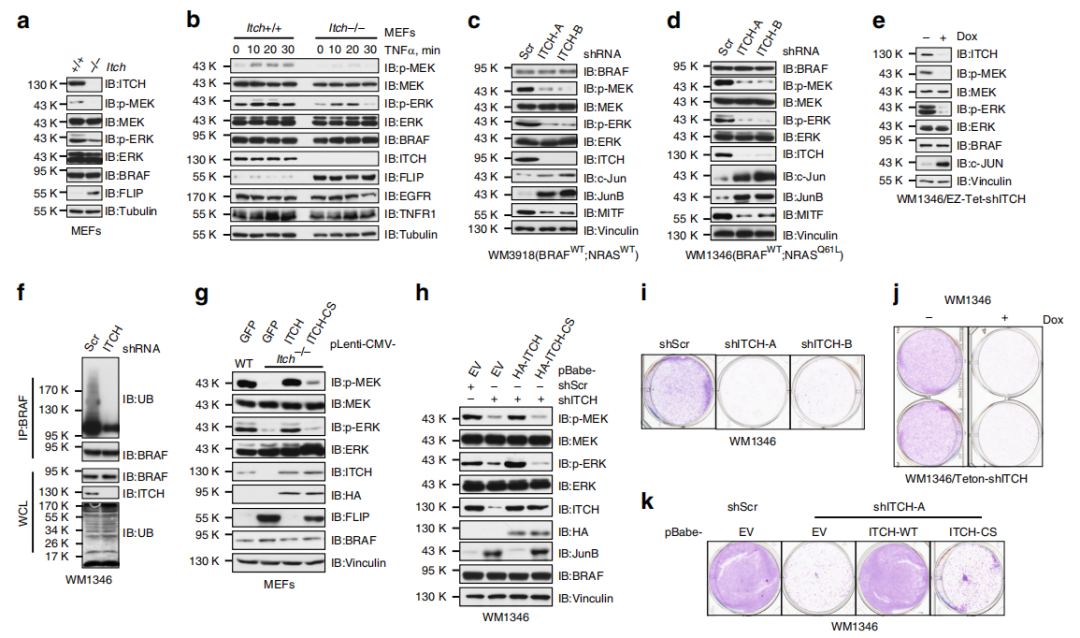
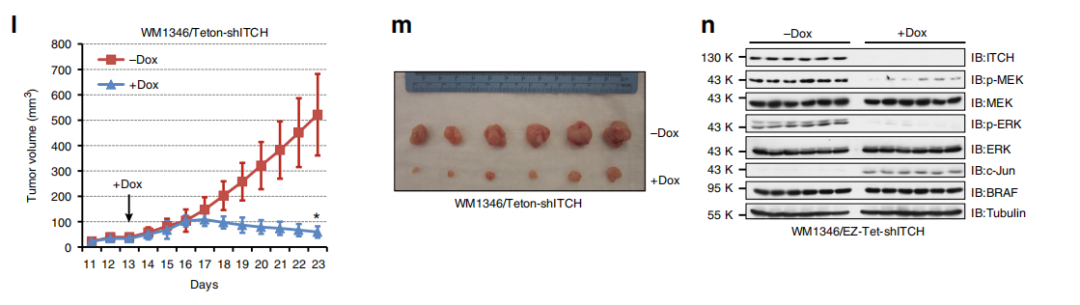
Fig 3. ITCH耗竭会减弱MEK / ERK信号传导和细胞生长。
作者接下来通过构建Itch缺失突变体株来研究ITCH是否是MEK / ERK信号级联反应的重要上游调节剂。与MEFs WT相比,Itch缺失的MEFs表现出降低的MEK / ERK活性(a),表明ITCH对BRAF功能的正调节作用。TNFα使得MEFs WT细胞中MEK / ERK信号快速激活,但是Itch缺失的MEFs细胞则对TNFα的刺激不敏感(b),在其他黑色素瘤细胞中也有同样的实验结果(d-e)。提示细胞因子诱导的MEK/ERK激活至少部分是通过ITCH途径的,且调节MEK / ERK信号转导依赖E3-连接酶活性(f-h)。
另外,作者发现ITCH敲降抑制细胞增殖(i,j),ITCH耗竭显著抑制了p-MEK / p-ERK信号转导和体内肿瘤生长。综上表明,ITCH可以积极调节BRAF / MEK / ERK信号级联,并促进BRAF WT黑色素瘤细胞的存活。
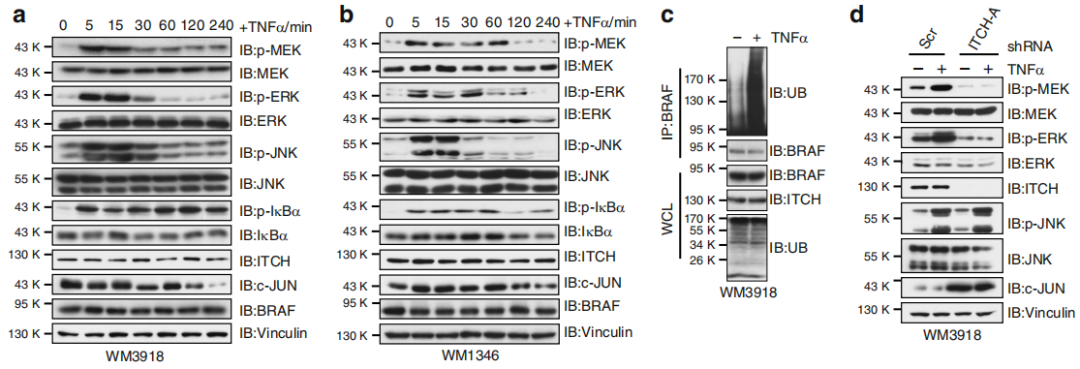
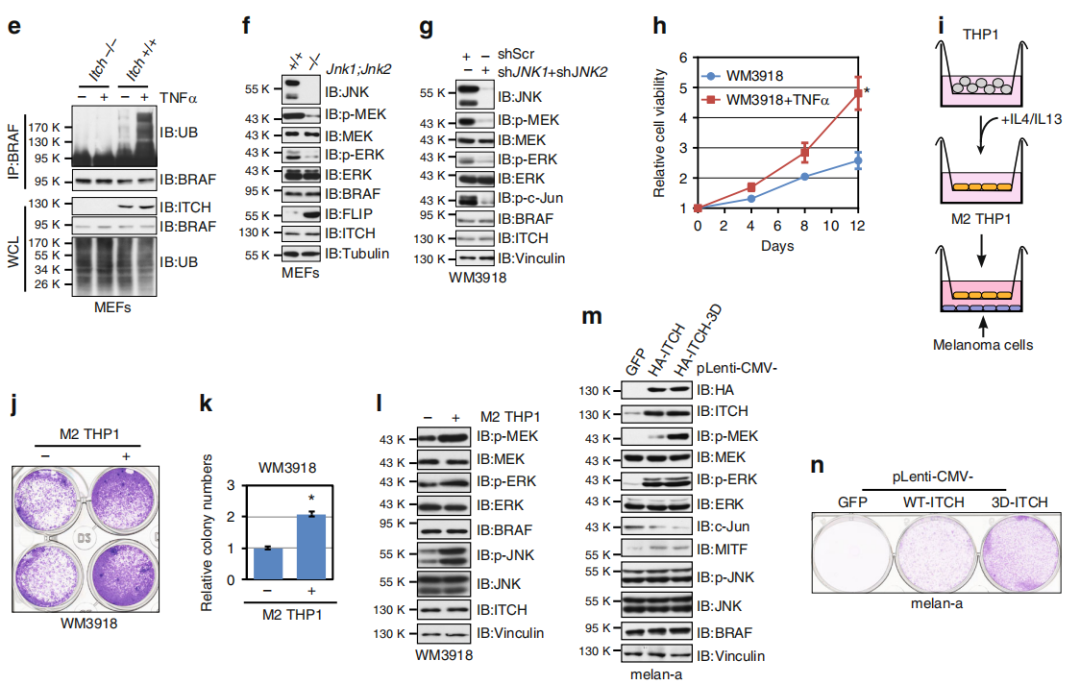
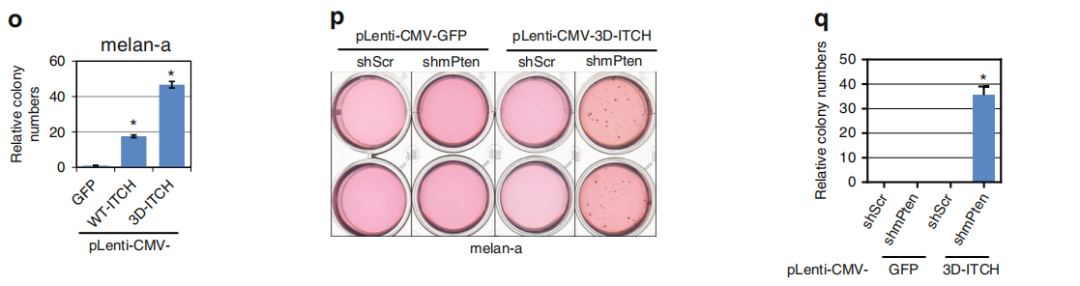
Fig 4. 细胞因子促进BRAF泛素化和激活
TNFα处理后诱导快速增加p-MEK/p-ERK水平,同时JNK水平上升(a,b),表明BRAF功能与 JNK/ITCH途径激活具有相关性。在黑色素细胞和黑色素瘤细胞中,TNFα处理后BRAF 泛素化增加(c),而ITCH耗竭的黑色素瘤细胞中p-MEK/p-ERK对TNFα治疗无效(d)。MEF中的Itch缺失可消除TNFα介导的BRAF泛素化(e)。MEF中Jnk1和Jnk2的缺失导致ITCH失活的同时导致p-MEK和p-ERK的水平降低(f)。此外,在黑色素瘤细胞中敲低JNK1和JNK2抑制了MEK和ERK活性(g)。与对照细胞相比,用TNFα或IL-1β处理的黑素瘤细胞显示出细胞生长增加(h)。肿瘤环境中促炎细胞因子的主要来源之一是肿瘤相关的巨噬细胞,特别是M2巨噬细胞。通过黑色素瘤细胞和M2巨噬细胞共培养(i),作者发现M2型的THP1细胞可以促进WM3918细胞的增殖(j,k),与对照细胞相比,在与M2型的THP1细胞共培养的细胞中观察到p-JNK,p-MEK和p-ERK水平升高(l)。
总结,细胞因子刺激激活JNK并促进ITCH激活进而促进BRAF泛素化和随后MEK / ERK信号升高。
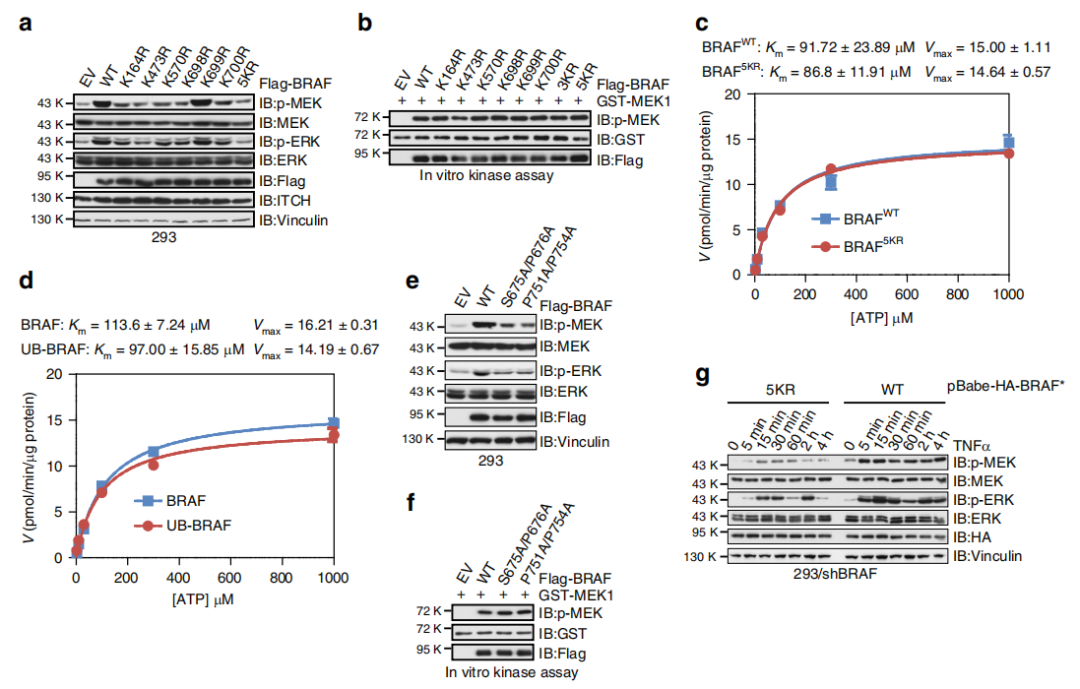
Fig 5. 泛素化缺乏的BRAF无法激活MEK / ERK
那么,BRAF的泛素化是否是下游因子激活的关键因子呢?与BRAFWT相比,除K699R外,所有KR突变体均表现低MEK / ERK活性(a)。BRAFKR突变体与BRAFWT表现出相似的磷酸化MEK1的活性(b)。此外,BRAFWT/BRAFKR在促进GST-MEK1磷酸化方面表现出相同的激酶动力学(c,d),表明KR突变几乎不影响BRAF蛋白的构象。缺乏ITCH结合缺陷的BRAF S675A / P676A和P751A / P754A突变体在促进细胞中MEK / ERK信号转导方面表现出降低的活性(e)。与表达BRAFWT的细胞相比,在表达BRAF5KR的细胞中,TNFα刺激极少触发p-MEK和p-ERK的活化(g)。以上证明,泛素化缺陷型BRAF5KR的细胞对细胞因子刺激无效。
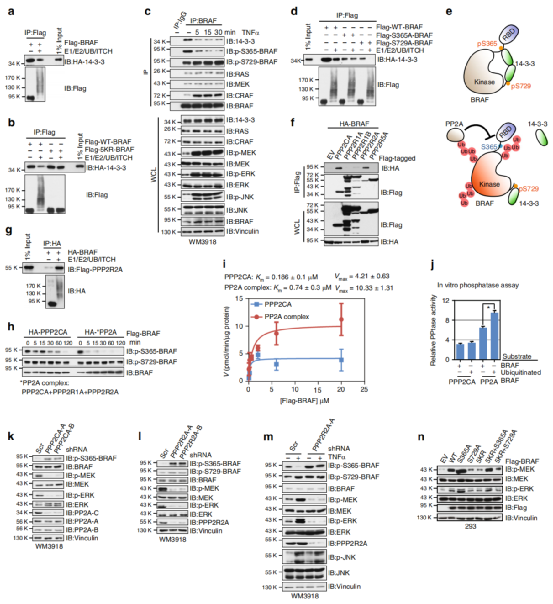
Fig6. 泛素化消除了BRAF / 14-3-3结合的抑制作用
与未修饰的BRAF相比,泛素化的BRAF与14-3-3的相互作用降低(a)。但是14-3-3与5KR-BRAF或ITCH结合区缺乏的BRAF的结合不受影响(b)。TNFα处理黑色素瘤细胞后,内源性BRAF与14-3-3蛋白的结合被减弱(c)。14-3-3二聚体介导的p-S365和p-S729位点的分子内相互作用使BRAF处于封闭的非活性构象,两个BRAF蛋白的分子通过p-S729位点与14-3-3二聚体结合而变得更加稳定,作者发现S365或S729的突变导致与14-3-3的结合减少,泛素化以及未泛素化的S365A-BRAF与14-3-3结合无显著差异(d)。因此,该结果证明K27位点的多聚泛素特异性干扰14-3-3与p-S365之间的结合(e)。
由于14-3-3与C末端p-S729位点的结合可促进RAF蛋白二聚化。
我们接下来试图确定BRAF多泛素化是否控制BRAF二聚化。作者假设K27连接的聚泛素链可能募集PP2A磷酸酶去磷酸化p-S365,从而导致与细胞中14-3-3的结合进一步减少(e),从而维持BRAF 驱动下游MEK / ERK信号的活动。作者发现,与未修饰的BRAF相比,泛素化的BRAF与PPP2R2A亚基具有更强的结合力(g)。为了支持PP2A在调节BRAF活性中的关键作用,作者发现在黑色素瘤细胞中,PPP2CA或PPP2R2A的耗竭导致p-S365-BRAF升高,MEK / ERK活性降低(k,1)。综上说明了BRAF K27位点的泛素化在破坏14-3-3介导的BRAF抑制中的独特作用。
备注:BRAF的上游调节子。14–3–3蛋白识别RSxpSxP或RxxxpSxP基序,其中pS代表磷酸丝氨酸。p-S365,而p-S729是在BRAF中发现的14–3–3相互作用位点。
PP2A家族:PPP2CA亚基和B55亚家族调节性亚基PPP2R2A与BRAF具有很强的结合力。PP2A全酶由三个亚基组成:支架亚基A,催化亚基C和四个调节亚基B。
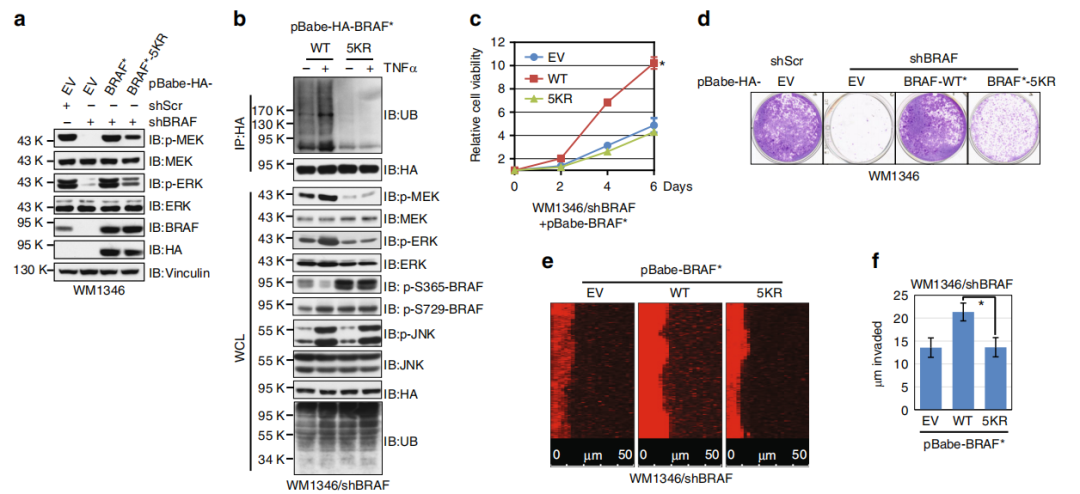
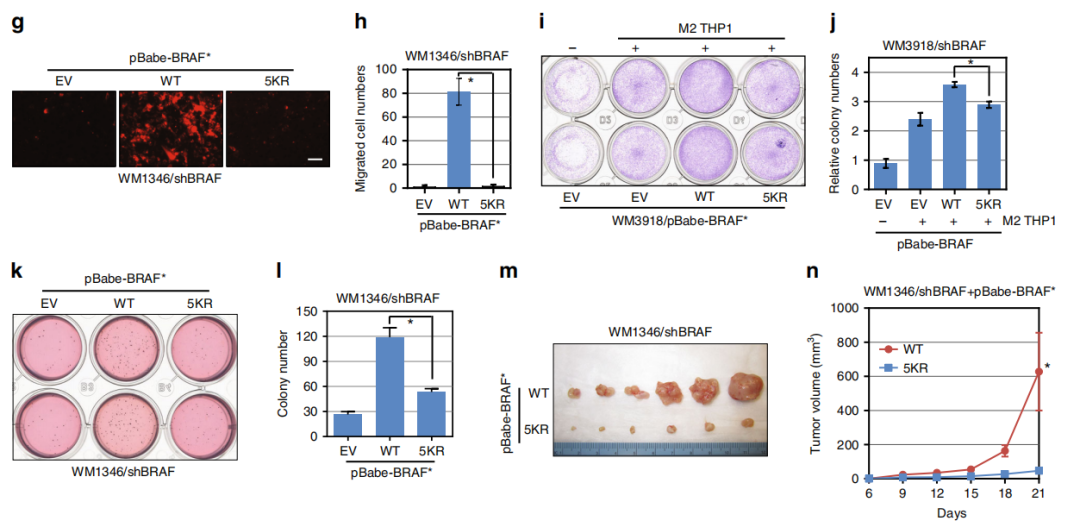
Fig7. 泛素缺乏的BRAF致瘤性较低
那是否泛素缺乏的BRAF突变体在BRAFWT的黑色素瘤细胞的生长和侵袭中表现出功能受损。作者发现与BRAFWT相比,泛素化缺乏的BRAF5KR无法促进BRAF缺失的黑色素瘤细胞中MEK / ERK的活化(a),且表达BRAF5KR的WM1346细胞对TNFα介导的MEK / ERK活化具有抵抗力,并伴随泛素化降低(b)。在BRAF敲除的细胞系中重建BRAFWT后发现细胞增殖被促进,而BRAF 5KR重建组则表现细胞增殖活性的降低(c,d)。表明K27位点的多泛素化在维持黑素瘤细胞中BRAF活性中起着至关重要的作用。
此外,表达BRAF5KR的细胞表现出低的基质胶(e,f)内皮细胞(g,h)的侵袭能力。M2分化的THP1细胞刺激了BRAFWT WM3918细胞的生长,但在BRAF5KR的细胞中却没有这种作用(i,j)。
BRAFWT的表达促进了免疫缺陷小鼠的肿瘤生长,但带有BRAF5KR的WM1346细胞体内致瘤性较小(m,n)。
综上,与BRAFWT相比(促进黑素瘤细胞的增殖和侵袭),泛素化不足的BRAF5KR突变体活性较低,且表现出受损的致癌功能,这些数据支持非典型泛素化BRAF的翻译后修饰,以维持黑色素瘤细胞中MEK / ERK信号转导的级联。
