

影响核酸凝胶电泳结果的因素分析
 2021-08-02 09:30:37
2021-08-02 09:30:37
来源/作者:普拉特泽生物-医学整体课题外包
以下文章转载自微信公众号 丰晖生物
凝胶电泳是一种常用的实验室技术,可鉴定、定量和纯化核酸片段。我们常用的是琼脂糖凝胶电泳,可以用来分离鉴定和纯化DNA片段。
将样品上样到琼脂糖胶的孔内并放入电场,使带负电荷的核酸向正极移动。蛋白质和核酸会根据pH不同带有不同电荷,在电场中受力大小不同,因此跑的速度不同,根据这个原理可将其分开。较短的DNA片段迁移较快,而最长的片段的迁移最为缓慢,从而实现基于DNA片段大小的分离。

每当提取完质粒之后在鉴定检测DNA时,制备使用琼脂糖凝胶的过程中应该要多注意,DNA酶污染的仪器可能会使DNA降解,造成条带信号弱、模糊甚至缺失的现象。为了得到更好的跑胶图,我们应该要考虑到以下几个影响DNA分子迁移率的因素:
①凝胶浓度
对于琼脂糖凝胶电泳,浓度通常在0.5~2%之间,低浓度的用来进行大片段核酸的电泳,高浓度的用来进行小片段分析,但是低浓度胶易碎,为了避免此现象,我们要小心操作和使用质量好的琼脂糖。注意高浓度的胶可能使分子大小相近的DNA带不易分辨,造成条带缺失的现象。
②缓冲液
在没有离子存在时(如误用蒸馏水配制凝胶,电导率最小,DNA几乎不移动,在高离子强度的缓冲液中(如误加10×电泳缓冲液),则电导很高并明显产热,严重时会引起凝胶熔化。
常用的缓冲液有TAE和TBE,而TBE比TAE有着更好的缓冲能力。电泳时使用新制的缓冲液可以明显提高电泳效果。电泳缓冲液多次使用后,离子强度降低,pH值上升,缓冲性能下降,可能会使DNA电泳产生条带模糊和不规则的DNA带迁移的现象。如图所示:
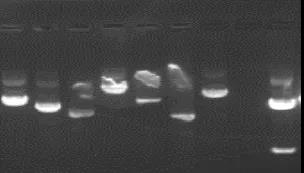
③电压和温度
电泳时电场强度不应该超过20 V/cm,电泳温度应该低于30℃。低电压时,线状DNA片段迁移速率与所加电压成正比。但是随着电场强度的增加,不同分子量DNA片段的迁移率将以不同的幅度增长,随着电压的增加,琼脂糖凝胶的有效分离范围将缩小。若要使大于2 kb的DNA片段的分辨率达到最大,所加电压不得超过5 v/cm,温度应该低于15℃。注意如果电泳时电压和温度过高,可能导致出现条带模糊和不规则的DNA带迁移的现象。特别是电压太大可能导致小片段跑出胶而出现缺带现象。
④DNA样品的纯度和状态
注意样品中含盐量太高和含杂质蛋白均可以产生条带模糊和条带缺失的现象。乙醇沉淀可以去除多余的盐,用酚可以去除蛋白。注意变性的DNA样品可能导致条带模糊和缺失,也可能出现不规则的DNA条带迁移。在上样前不要对DNA样品加热,用20 mM NaCl缓冲液稀释可以防止DNA变性。
⑤DNA的上样
正确的DNA上样量是条带清晰的保证。DNA上样量大可能导致DNA带型模糊对判断其大小有影响,而太小的DNA上样量则导致带信号弱甚至缺失。
⑥Marker的选择
DNA电泳一定要使用DNA Marker或已知大小的正对照DNA来估计DNA片段大小。Marker应该选择在目标片段大小附近ladder较密的,这样对目标片段大小的估计才比较准确。需要注意的是Marker的电泳同样也要符合DNA电泳的操作标准。
⑦凝胶的染色和观察(针对用EB染色的凝胶)
实验室常用的核酸染色剂是溴化乙锭(EB),染色效果好,操作方便,但是稳定性差,具有毒性。注意观察凝胶时应根据染料不同使用合适的光源和激发波长,如果激发波长不对,条带则不易观察,出现条带模糊的现象。
最后我们来分析几个凝胶图:
DNA如果降解或者混有其他杂质比如蛋白质、RNA的话,在电泳中我们是可以检测的到的。线性的单一DNA样品一般是单条带,质粒的话可能会有2-3条带,这和DNA分子的构象有关,如图一所示:
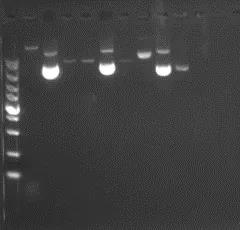
图一
如果条带变宽、变暗、或者变成弥散的DNA条带,表示DNA非特异的降解,还有一种可能是太久没有更换电泳缓冲液造成的。如图二所示:
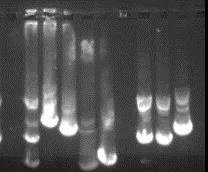
图二
如果有蛋白质污染,上样孔可能发亮。如图三所示:
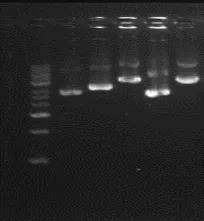
图三
如果跑胶时DNA上样量过多导致条带宽度大,无法准确判断其大小。

好,以上就是今天关于
“影响核酸凝胶电泳结果的因素分析”的全部内容了,
你看懂了么?
如果有疑问可以留言噢~


