

大鼠外周血Th17细胞流式染色案例
 2021-06-11 10:00:39
2021-06-11 10:00:39
来源/作者:普拉特泽生物-医学整体课题外包
Th17细胞简介
辅助性T细胞17(T helper cell 17,Th17)是一种新发现的能够分泌白介素17(interleukin 17,IL-17)的T细胞亚群,在自身免疫性疾病和机体防御反应中具有重要的意义。β转化生长因子(transforming growth factor b,TGF-β)、IL-6、IL-23和IL-21在Th17细胞的分化形成过程中起着积极的促进作用,而γ干扰素(interferon γ,IFN-γ)、IL-4、细胞因子信号传送阻抑蛋白3(suppressor of cytokinesignaling 3,Socs3)和IL-2则抑制它的分化。
Th17细胞是一类产生IL-17的Th细胞亚群,与许多炎症反应和自身免疫性疾病的发生和发展有关。大量研究表明,IL-17与实验性自身免疫性脑炎(EAE)、哮喘、类风湿性关节炎(RA)等自身免疫性疾病明显相关。已有研究发现,被致病抗原髓鞘蛋白(PLP)致敏的CD4+T细胞经IL-23刺激后可产生大量的IL-17,将这些产生IL-17的细胞被动地转移给小鼠后可引发严重的EAE,给予抗IL-17中和性抗体可以部分抑制EAE的发生。Komiyama等在实验性自身免疫性脑炎的小鼠模型中,IL-17mRNA基因水平和蛋白质水平均升高。
大鼠外周血Th17细胞流式染色实例
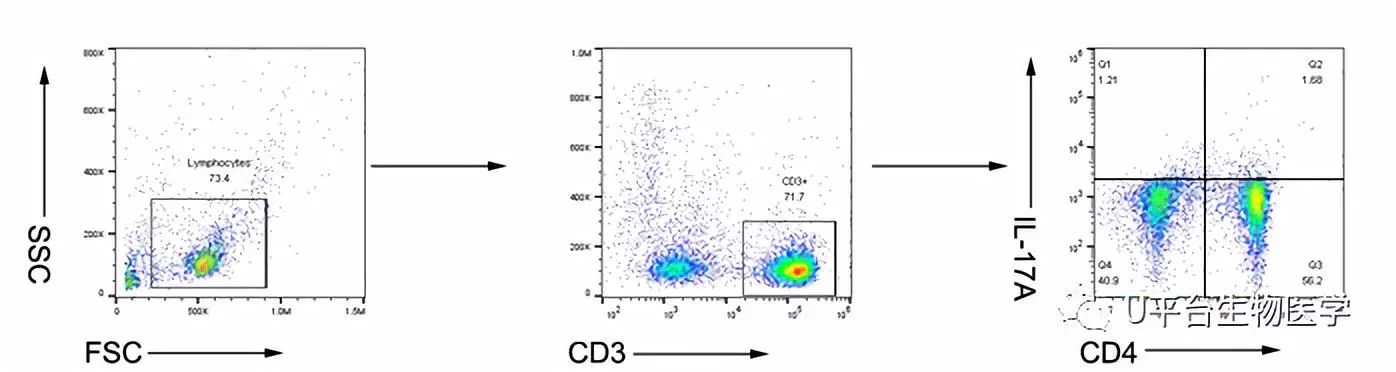
图1 大鼠外周血Th17细胞画门策略
Rat (Blood): IL-17A+ CD4+T cells
1. 标志物:Th17 cells (CD3+CD4+IL-17A+);
2. 流式细胞仪:CytoFLEX,Beckman Coulter;
3. 流式抗体及用量: (PE anti-rat CD3,2.5μL/test, 201411,Biolegend),FITC anti-rat CD4 (0.5μL/test, 201505, Biolegend), APC anti-rat IL17 (0.625μL/test,17-7177-81, eBioscience);
4. 分析软件:FlowJo V10;
5. 圈门策略及染色:见上图。
大鼠外周血淋巴细胞分离
血液准备:取2mL外周血加入2mL生理盐水,混匀;
LymphoprepTM分离液(即用型)使用前平衡至室温,在15mL离心管底部加入3mL分离液,将第1步混好的血液小心铺在分离液上面,室温,800g离心25 min;
吸取白膜层细胞到新的15m离心管中,加入10mL左右的PBS或者培养基洗细胞一次,350g离心5 min。
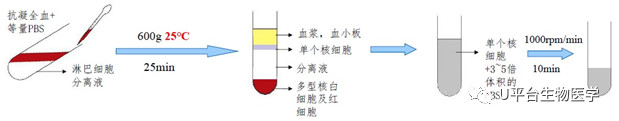
图2 淋巴细胞分离流程图
细胞刺激及流式染色
含10%FBS的1640培养基稀释细胞密度到4x106cells/mL,取500µL细胞悬液到24孔板中,每孔加入2µL的Cell Activation Cocktail (withBrefeldin A),在37℃的CO2培养箱培养4.5h;
流式染色实验步骤:准备流式上样管,并做好相应的标记。
收集体外刺激培养的细胞,350g离心5 min,用1mL的Cell Staining Buffer重悬细胞,350g离心5 min。
按照管设置分别加入相应的表面标记抗体,混匀后,室温避光孵育15-20 min。
加入至少2mL的细胞染色液洗1次,350g离心,5 min,弃上清。
加入Fixation Buffer (Cat# 420801)固定细胞,每管0.5mL固定液,室温避光孵育固定20 min。
350g,离心,5 min,弃上清。
用去离子水将10×的Permeabilization Wash Buffer (Cat# 421002) 稀释成1×的工作液。
用1mL 1×的Permeabilization Wash Buffer重悬固定的细胞,350g离心5-10 min,弃上清。
重复步骤两次。
用100µL Permeabilization Wash Buffer 重悬固定破膜后的细胞,加入特定的荧光标记抗体(抗体量根据说明书加),室温避光20 min。
用 2mL Permeabilization Wash Buffer洗细胞两遍。350g离心5 min,弃上清。
加入0.5mL的Cell Staining Buffer重悬细胞。
