

什么是脑缺血动物模型构建?
 2025-04-18 15:37:05
2025-04-18 15:37:05
来源/作者:普拉特泽-生物医学整体课题外包平台
大家好!今天普拉特泽生物继续带大家一起学习新实验——脑缺血动物模型构建,脑缺血动物模型是研究脑卒中病理机制和药物筛选的重要工具,通过模拟人类脑缺血疾病状态,为科学研究提供可控的实验平台。这类模型能够帮助研究人员深入了解脑缺血后的病理生理变化,评估神经保护策略的有效性,并推动新治疗方法的开发。随着脑卒中成为全球致残和致死的主要原因之一,建立可靠的脑缺血动物模型显得尤为重要。普拉特泽生物动物实验平台长期为大家提供脑缺血动物模型构建实验代做外包服务,本文跟大家分享什么是脑缺血动物模型构建?
①脑缺血动物模型的主要构建方法
——线栓法(MCAO)构建局灶性脑缺血模型
线栓法(大脑中动脉阻塞模型,MCAO)是目前应用最广泛的局灶性脑缺血模型构建技术。该方法通过颈外动脉插入硅胶涂层的尼龙线栓,经颈内动脉推进至大脑中动脉起始部,阻断血流形成缺血核心及半暗带。
关键技术要点包括:精确控制线栓插入深度(通常18-22mm,取决于动物品种和体重)、保持稳定的栓线直径(常用0.22-0.28mm)以及确保恰当的缺血时间(通常1-2小时可逆缺血或24小时永久缺血)。
线栓法MCAO模型的优势在于能够模拟人类缺血性卒中的大部分病理特征,包括血流动力学改变、血脑屏障破坏和炎症反应等。该模型重复性好,可根据需要调整缺血时间和再灌注时间,适用于神经保护剂评价和再灌注损伤研究。
然而,技术难度较高,需要熟练的显微外科操作技巧,且存在蛛网膜下腔出血等并发症风险。
——光化学诱导法构建精准缺血模型
光化学诱导血栓形成是一种精准定位的脑缺血模型构建方法。其原理是通过系统注射光敏染料(如玫瑰红B),然后用特定波长(通常560nm)激光照射目标血管区域,引发内皮损伤和血小板聚集,形成局灶性血栓。这种方法的主要优点在于:缺血部位精确可控(皮层或深部均可)、无需开颅手术、且可建立不同大小的梗死灶。
光化学法的操作流程包括:麻醉固定动物→剃除头部毛发→静脉注射光敏剂→激光照射预定脑区(通过颅骨或开颅窗)。该模型特别适合研究血栓形成机制、抗血小板药物评价以及血管再通过程。但需注意光照参数(强度、时间)和光敏剂剂量需要严格优化,以避免过度损伤或效果不足。
——其他常用脑缺血模型构建技术
除上述两种主流方法外,科研人员还开发了多种脑缺血模型构建技术:
四血管闭塞法(4-VO)是一种经典的全脑缺血模型,通过阻断两侧椎动脉和颈总动脉实现全脑血流中断。该方法可模拟心脏骤停后的脑损伤,适用于研究选择性神经元死亡和海马CA1区损伤机制。操作复杂但重复性好,需分两步进行(先电凝椎动脉,次日夹闭颈总动脉)。
内皮素-1注射法是另一种局灶性缺血模型,通过立体定位向目标脑区注射这种强效血管收缩剂,引起局部血管痉挛和血流下降。优点是可精确定位任何脑区且创伤小,但缺血程度和持续时间较难控制均一。
——脑缺血模型构建的关键技术参数
动物选择与术前准备
脑缺血模型构建的动物选择对实验结果有重大影响。最常用的是成年雄性Sprague-Dawley或Wistar大鼠(体重250-300g),因其脑血管解剖清晰、成本较低且对缺血敏感。小鼠模型(如C57BL/6)则适用于转基因研究,但手术难度更大。大型动物(如家兔、猪、猴)更接近人类脑生理,但成本高且伦理限制多。
术前准备包括:禁食4-6小时(不禁水)、称重记录、术前神经功能评分(Bederson评分等)。麻醉选择也很关键,常用异氟烷(1.5-2%)或氯胺酮/赛拉嗪组合,需维持体温在37±0.5℃(使用温控垫和直肠探头)。术前应准备好无菌手术器械、抗凝剂(如肝素盐水)和术后镇痛药物(如布托啡诺)。

②手术操作标准化流程
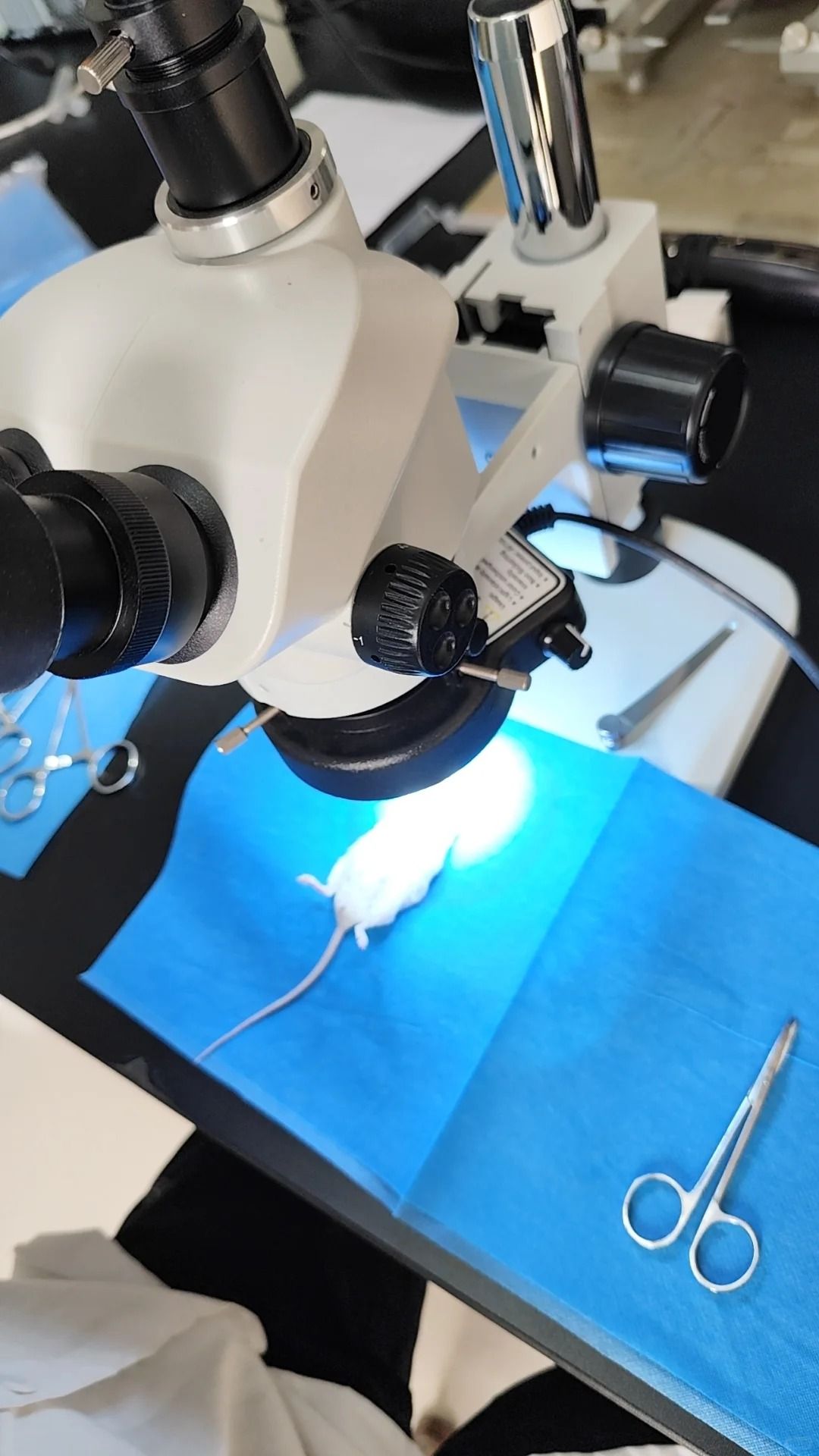
建立可重复的脑缺血模型需要严格遵循标准化手术流程。以线栓法MCAO为例:颈部正中切口→分离颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)→结扎ECA分支→暂时夹闭CCA和ICA→ECA切口插入线栓(硅胶头朝向ICA)→松开ICA夹,推进线栓至预定深度(遇轻微阻力停止)→固定线栓并关闭切口。
关键操作要点包括:保持血管湿润(用温生理盐水)、避免过度牵拉血管(防止痉挛)、控制出血(使用微型双极电凝)、确保线栓正确进入ICA(而非翼腭动脉)。建议新手进行尸检练习和墨汁灌注验证线栓位置后再开展正式实验。
③术后管理与并发症预防
成功的脑缺血模型构建离不开精细的术后管理。再灌注模型需轻柔撤出线栓并确认ECA血流恢复。术后应将动物置于温暖(28-30℃)、安静的环境单独饲养,密切观察意识恢复情况(右ing reflex)、自主活动和进食情况。
常见并发症及处理:蛛网膜下腔出血(操作轻柔可预防)、癫痫发作(可用地西泮控制)、呼吸抑制(维持气道通畅)、体重下降(提供软食和水凝胶)。建议术后24小时内每2-4小时评估一次神经功能,采用标准化评分量表如mNSS(modified Neurological Severity Score)或Garcia评分。
④脑缺血模型的评价与验证
——神经行为学评估方法
可靠的脑缺血模型必须通过多维度验证确认其有效性。神经功能缺损评估是首要指标,常用方法包括:
▲肢体对称性测试:提尾观察前肢屈曲情况(缺血对侧肢体通常伸展)
▲转圈行为:自发或诱导向缺血对侧转圈
▲平衡木行走测试:评估运动协调性(分0-4级评分)
▲触觉刺激反应:用棉签轻触胡须观察转头反应
▲肌力测试:握力计测量前肢力量不对称性
建议组合使用2-3种测试方法,在术后24小时、72小时等时间点纵向评估,以反映神经功能变化轨迹。注意评估环境应保持安静、光线一致,由不知分组的研究者盲法评分。
⑤影像学验证技术
——现代影像技术为脑缺血模型提供了客观的验证手段:
MRI检查是金标准,T2加权像可清晰显示梗死灶(高信号),DWI(弥散加权成像)在缺血后数分钟即可检测异常。梗死体积测量通常采用TTC染色后的切片图像分析软件(如ImageJ),计算校正后的百分比体积以消除脑水肿影响。
激光多普勒血流仪可在术中实时监测局部脑血流(rCBF),确认血流下降至基线的20%以下表明模型成功。近红外光谱(NIRS)则能无创监测脑氧合变化。小动物PET/CT可评估脑代谢(如18F-FDG摄取降低)。
①组织病理学分析
终末点组织学分析是验证脑缺血模型的必要步骤:
TTC(2,3,5-氯化三苯基四氮唑)染色是最常用的梗死评估方法,正常组织染红色而梗死区苍白色。需在缺血后24-72小时取脑,切片后37℃孵育15-20分钟。梗死体积计算应排除水肿影响,公式为:对侧半球体积-(同侧非梗死区体积)。
HE染色可观察神经元形态变化(如嗜酸性变、核固缩)。免疫组化检测胶质纤维酸性蛋白(GFAP)反映星形胶质细胞活化,IBA1标记小胶质细胞增生。Fluoro-Jade B染色可特异性显示变性神经元。
②脑缺血模型的应用与优化
在药物研发中的应用
脑缺血动物模型在神经保护剂筛选中发挥核心作用。理想的药物评价实验设计应包括:预处理(缺血前给药)和后处理(再灌注后给药)组别,使用盲法随机分组,设立阳性对照(如依达拉奉)。评价指标应组合行为学、梗死体积和生物标志物(如S100β、NSE)。
模型也可用于研究溶栓治疗效果。例如,在栓塞型卒中模型中评估tPA(组织型纤溶酶原激活剂)的时间窗(通常<4.5小时)和出血转化风险。联合用药策略(如tPA加抗氧化剂)也常借助此类模型优化。
③转基因动物模型的应用
转基因技术为脑缺血研究提供了基因功能分析的强大工具。例如:
APP/PS1小鼠研究卒中后认知障碍
Nrf2敲除小鼠探索氧化应激机制
TLR4突变体研究炎症反应作用
细胞特异性敲除(如GFAP-Cre)解析不同细胞类型的贡献
转基因模型构建需考虑背景品系的影响(C57BL/6对缺血较耐受),常需调整缺血时间。建议同时使用野生型同窝仔作为对照,并增加样本量抵消个体差异。
好,今天关于
就说到这里
觉得有用欢迎转发收藏
还可以加入我们实验交流群进行交流学习分享实验

