

CHIP引物设计结果分析
 2024-11-19 13:45:52
2024-11-19 13:45:52
来源/作者:普拉特泽-生物医学整体课题外包平台
染色质免疫共沉淀(Chromatin Immunoprecipitation,ChIP)技术是一种研究蛋白质与DNA相互作用的重要方法。在ChIP实验中,特定的蛋白质与DNA结合的区域会被抗体“拉下来”
然后通过PCR、测序等方法来鉴定这些绑定的DNA区域。
想学习更详细的实验操作步骤的同学欢迎点击我们的春风学院——《CHIP染色质免疫沉淀理论与实操演示》专栏继续学习哦,当然如果您有CHIP引物设计外包的需求,普拉特泽随时在线任君采撷哦!
成功的ChIP实验不仅依赖于高质量的抗体和样本制备,还需要合理的引物设计。本文将详细介绍ChIP引物设计的过程和结果分析。
一、ChIP引物设计原则
①目标基因或DNA区域的选择:
ChIP引物的设计首先需要确定目标基因或DNA区域。这通常基于预测软件如JASPAR、ENCODE的预测结果,或先前的研究数据。
②结合位点的预测:
利用生物信息学工具预测蛋白质可能结合的DNA序列,确保引物能够特异性地扩增目标区域。预测结果可以为引物设计提供重要参考。
③引物设计:
产物长度:ChIP-qPCR实验中,设计引物扩增出来的片段最好在100-150 bp之间。这是因为如果产物过长,在ChIP过程中超声处理可能会将DNA打断得太短,导致无法验证。
熔解温度(Tm):优化引物的熔解温度,确保PCR反应的效率和特异性。
GC含量:适当调节GC含量,避免引物二级结构的形成。
④BLAST验证:
使用BLAST工具(如NCBI的Primer-BLAST)验证引物的特异性,确保它们不会扩增出其他非目标DNA区域。

二、ChIP引物设计实例
假设我们已经有高通量的ChIP-seq结果,需要根据测序结果设计引物。以下是具体步骤:
【1】获取DNA序列:
通过UCSC基因组浏览器获取目标位置的DNA序列。选择相应的基因组版本(如hg38),输入序列位置,即可获得所需的DNA序列。
【2】设计引物:
在Primer-BLAST中粘贴DNA序列,设置PCR模板长度(如250 bp),调整C、G比例,然后按照正常设计引物的步骤进行。
【3】验证引物:
使用UCSC-BLAST工具验证引物的特异性。选择目标区域(编码区或非编码区),查看BLAST结果,确保引物只扩增目标DNA区域。


三、ChIP引物设计结果分析
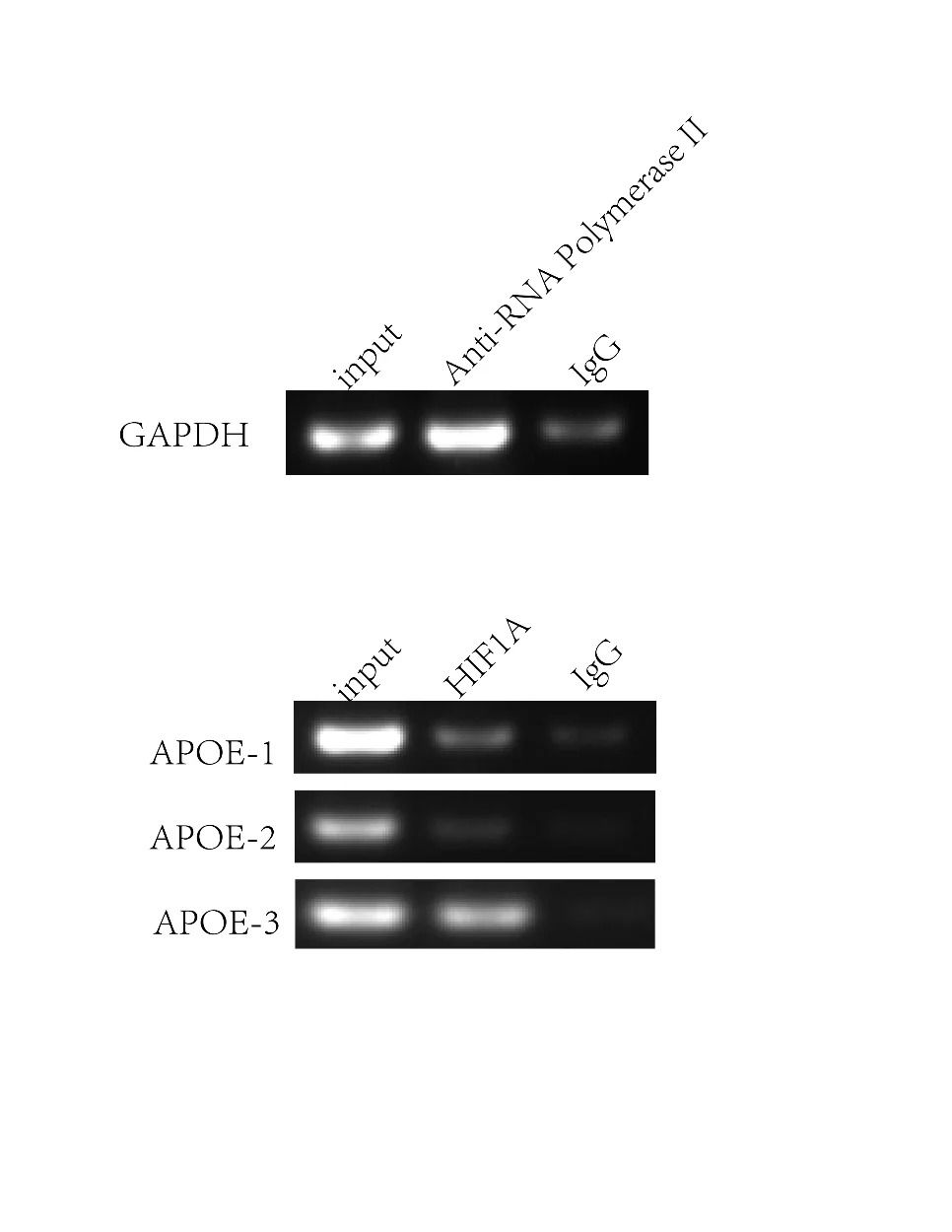
▲引物特异性:
通过BLAST验证,确保设计的引物具有高度的特异性,不会扩增出其他非目标DNA区域。这是ChIP实验成功的关键之一。
▲PCR验证:
在含有目标DNA的模板和不含目标DNA的负对照样本上进行PCR验证,进一步确认引物的特异性。
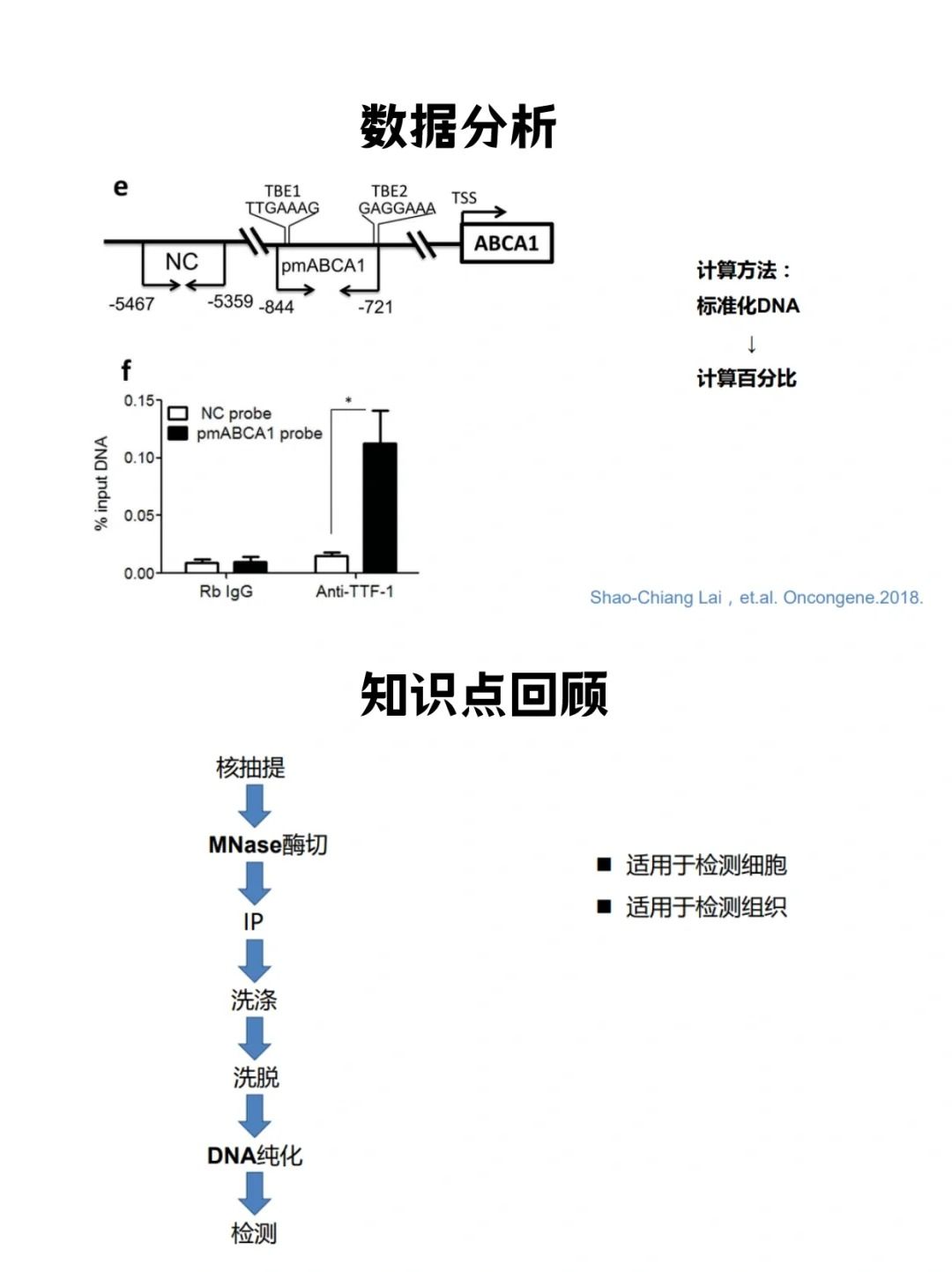
▲ChIP-qPCR结果分析:
●标准曲线的建立:
通过稀释不同比例的Input样本建立qPCR标准曲线,确定PCR反应效率。
●富集效率的计算:ChIP-qPCR的富集效率通常以相对Input信号的富集比例来呈现。计算公式如:% of Input = (2^(-ΔΔCt)) × 100%,其中ΔΔCt为实验样本与Input样本的CT值之差。
●结果分析:比较阳性对照、阴性对照及目的蛋白组的富集丰度,根据CST科学家给出的质控标准,判断ChIP结果是否为真阳性。
四、结论
ChIP引物设计是ChIP实验成功的关键步骤之一。通过合理的引物设计,可以确保ChIP实验能够特异性地扩增目标DNA区域,从而准确研究蛋白质与DNA的相互作用。
在引物设计过程中,需要综合考虑目标基因的信息、生物信息学预测、引物设计原则以及实验验证结果。最终,通过ChIP-qPCR结果的分析,可以进一步验证引物的特异性和实验的可靠性。
好,今天关于CHIP引物设计
结果分析
就说到这里
觉得有用欢迎转发收藏

