


细胞自噬
自噬是指从粗面内质网的无核糖体附着区脱落的双层膜包裹部分胞质和细胞内需降解的细胞器、蛋白质等成分形成自噬体(autophagosome),并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞本身的代谢需要和某些细胞器的更新。自噬是细胞内成分降解代谢过程中的膜转运过程,在营养或能量匮乏的条件下被激活。生理和病理状态下,自噬均是维持机体内稳态的关键,自噬的改变与临床相关的各种疾病,如:神经退行性疾病、肿瘤的发生及放化疗抵抗,以及心脏相关的疾病有关。自噬是有利的还是有害的取决于持续时间是否恰当以及被诱导的程度。
图 1日本科学家大隅良典
自噬的发生在时间上可以分为5个阶段:
1.隔离膜形成:细胞质中的线粒体等细胞器首先被称为“隔离膜”的囊泡所包被,这种“隔离膜”主要来自于内质网和高尔基体。
2.初始自体吞噬泡形成:囊泡最终形成双层膜结构,即自吞噬体,也称之为初始自体吞噬泡。
3.中间自体吞噬泡形成:自吞噬体与胞内体融合形成中间自体吞噬泡;
4.降解自体吞噬泡形成:自体吞噬泡的外膜与溶酶体融合形成降解自体吞噬泡;
5.自噬溶酶体降解:由溶酶体内的酶降解自体吞噬泡中的内容物和内膜。
Tips:在整个自体吞噬过程中,细胞质和细胞器都受到破坏,最明显的是线粒体和内质网受损。虽然自体吞噬并不直接破坏细胞膜和细胞核,但是有证据表明,在最初断裂或消化后,细胞膜和细胞核会最终变成溶酶体以消化和分解自身。
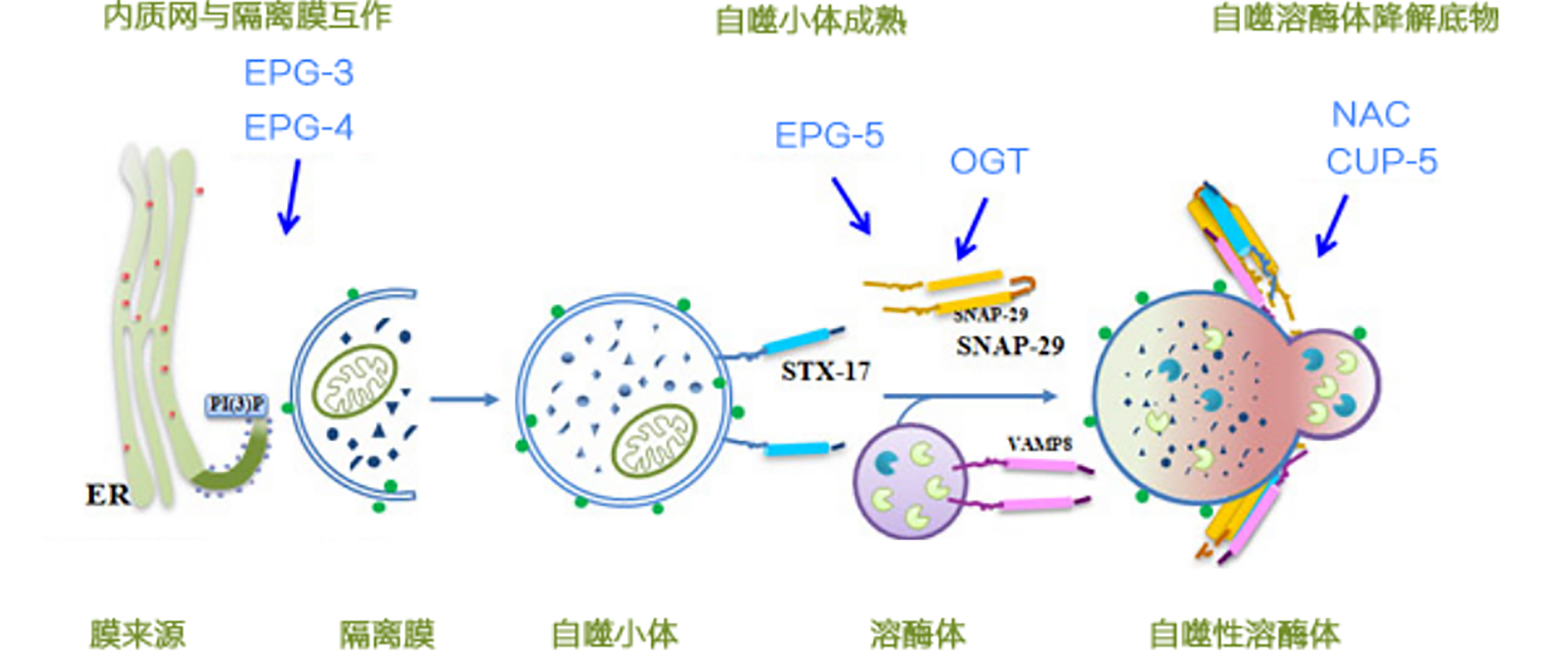
图 2自噬过程
根据细胞物质运到溶酶体内的途径不同,自噬分为以下几种。
大自噬 由内质网来源的膜包绕待降解物形成自噬体,然后与溶酶体融合并降解其内容物;
分子伴侣介导的自噬(CMA) :胞质内蛋白结合到分子伴侣后被转运到溶酶体腔中,然后被溶酶体酶消化。CMA 的底物是可溶的蛋白质分子,在清除蛋白质时有选择 性,而前两者无明显的选择性。
小自噬 :溶酶体的膜直接包裹长寿命蛋白等,并在溶酶体内降解;
内体微自噬 :许多透过细胞吞噬的物质,会先形成内体(endosome),然后跟溶酶体融合并且进行消化。
:目前研究的较多的是大自噬,其中2016年Shelley L. Berger等在Nature发表名为“Autophagy mediates degradation of nuclear lamina”的文章 ,首次提出了核 自噬参与调控核纤层的降解:哺乳动物细胞中,在致瘤性的诱导条件下会激发LC3与LaminB1蛋白结合并诱发核自噬,饥饿和雷帕霉素并不能诱导哺乳动物核自噬的 发生。
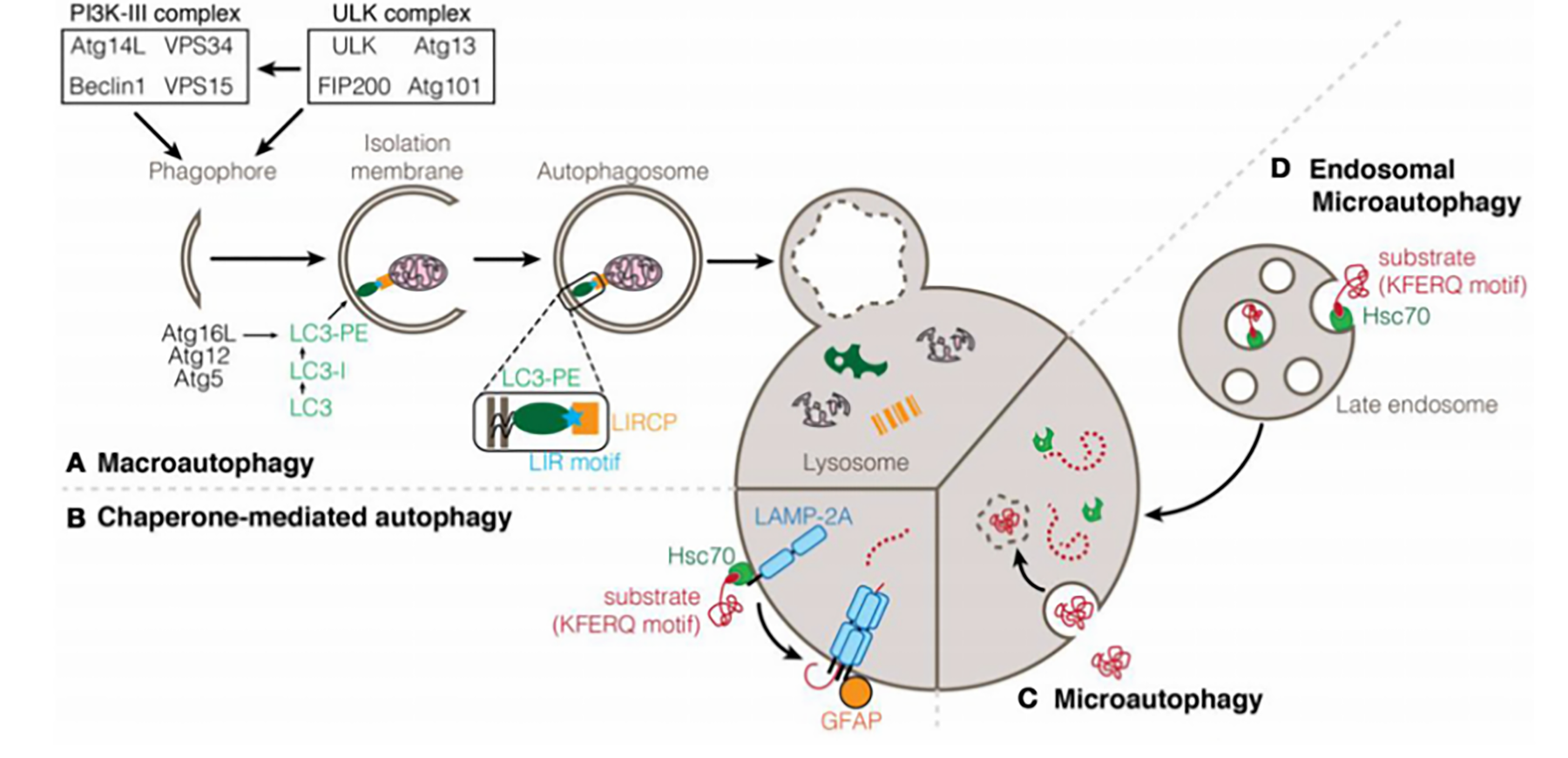
图 3自噬的分类
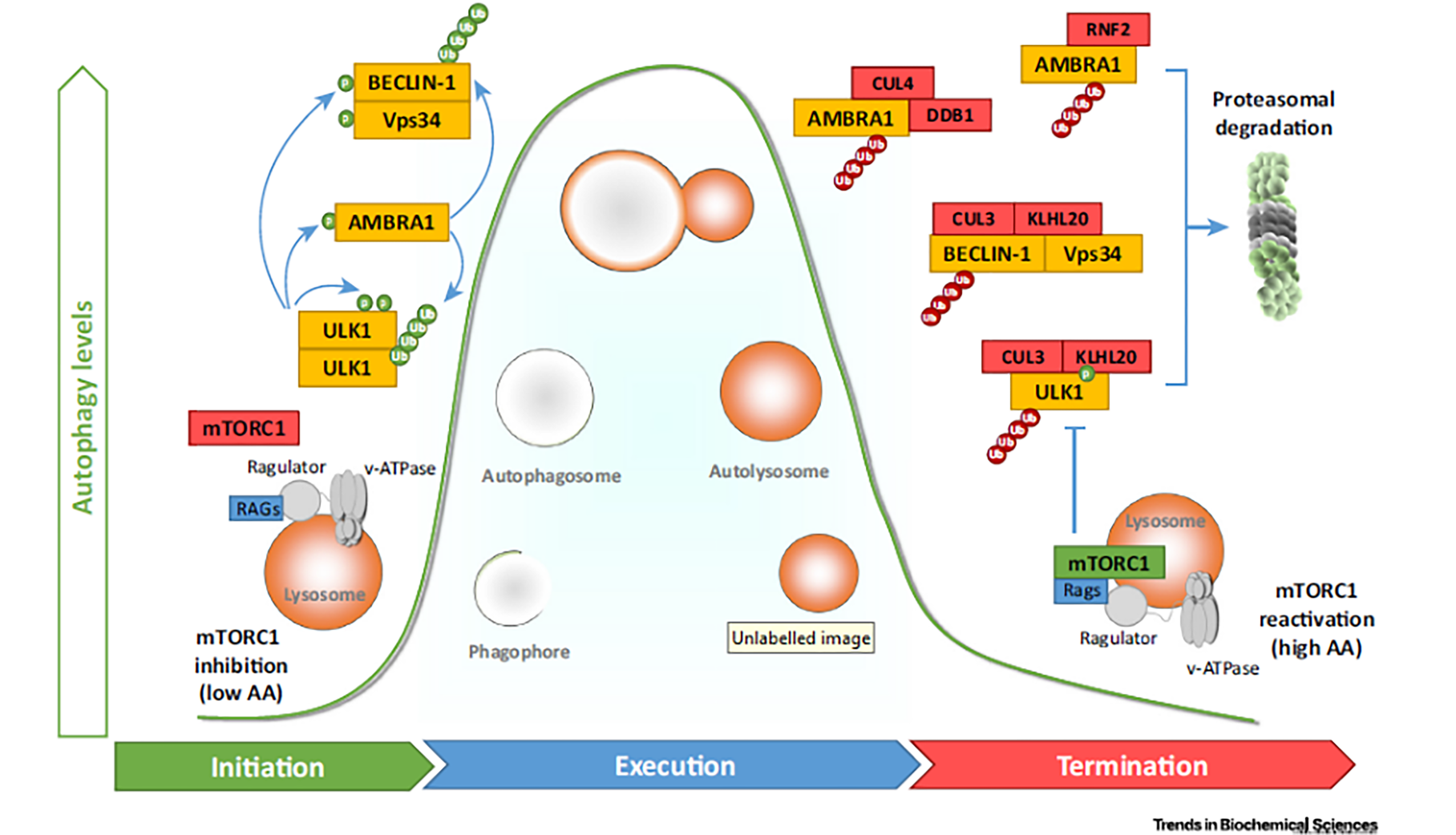
图 4营养饥饿中自噬反应的分子调控(起始-执行-终止)
营养缺乏导致mTORC1失活,从溶酶体膜游离,激活许多翻译后修饰促进ULK和VPS34复合物的活化(即自噬起始)。一旦ULK和VPS34复合物被激活,自噬的执行程序被允许(即自噬的执行)。自噬终止:由E3泛素连接酶执行的ULK和BECLIN-1活性复合物介导完成。此外,由溶酶体消化产生的氨基酸重新激活mTORC1,它能够反过来抑制自噬发生。(来自综述:Emerging Mechanismsin Initiating and Terminating Autophagy)
1. 自噬的诱因 :细胞正常情况下很少发生自噬,除非有诱发因素的存在。来自于细胞外的(如外界中的营养成分、缺血缺氧、生长因子的浓度等),也有细胞内的(代谢压 力、衰老或破损的细胞器、折叠错误或聚集的蛋白质等)。由于这些因素的经常性存在,因此,细胞保持了一种很低的、基础的自噬活性以维持自稳。
2. 自噬的时间 :自噬的过程过程很快,被诱导后8min即可观察到自噬体形成,2h后自噬溶酶体基本降解消失。这有利于细胞快速适应恶劣环境。
3. 自噬的可诱导特性 :表现在2个方面,第一是自噬相关蛋白的快速合成,这是准备阶段。第二是自噬体的快速大量形成,这是执行阶段。
4. 自噬的批量降解 :这是与蛋白酶体降解途径的显著区别。
5. 自噬的非特异性 :由于自噬的速度要快、量要大,因此特异性不是首先考虑的,这与自噬的应急特性是相适应的。
6. 自噬的保守性 :由于自噬有利于细胞的存活,因此无论是物种间、还是各细胞类型之间(包括肿瘤细胞),自噬都普遍被保留下来。由于自噬研究的历史关系,很多基因在 酵母和哺乳动物中有不同的命名。
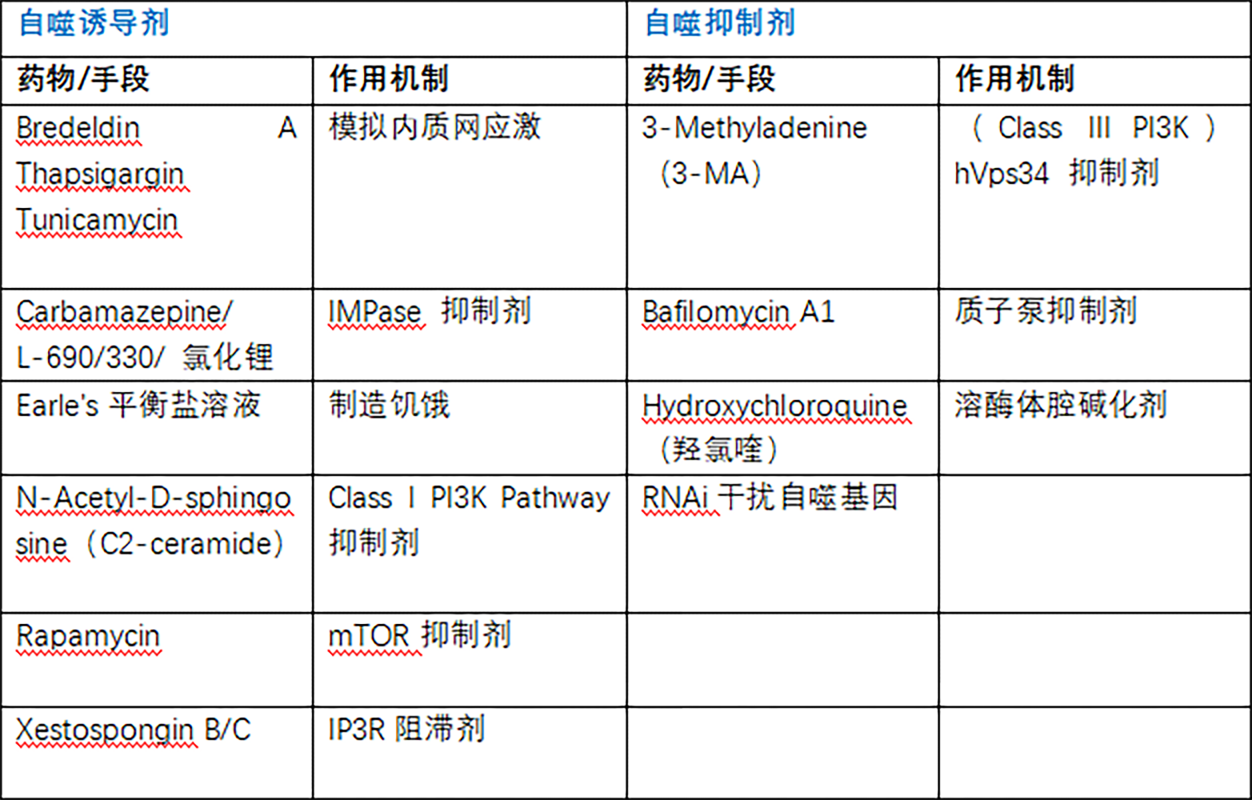
Tips :血清饥饿/氨基酸饥饿/葡萄糖饥饿等饥饿手段均可诱导不同机制调控的自噬发生。
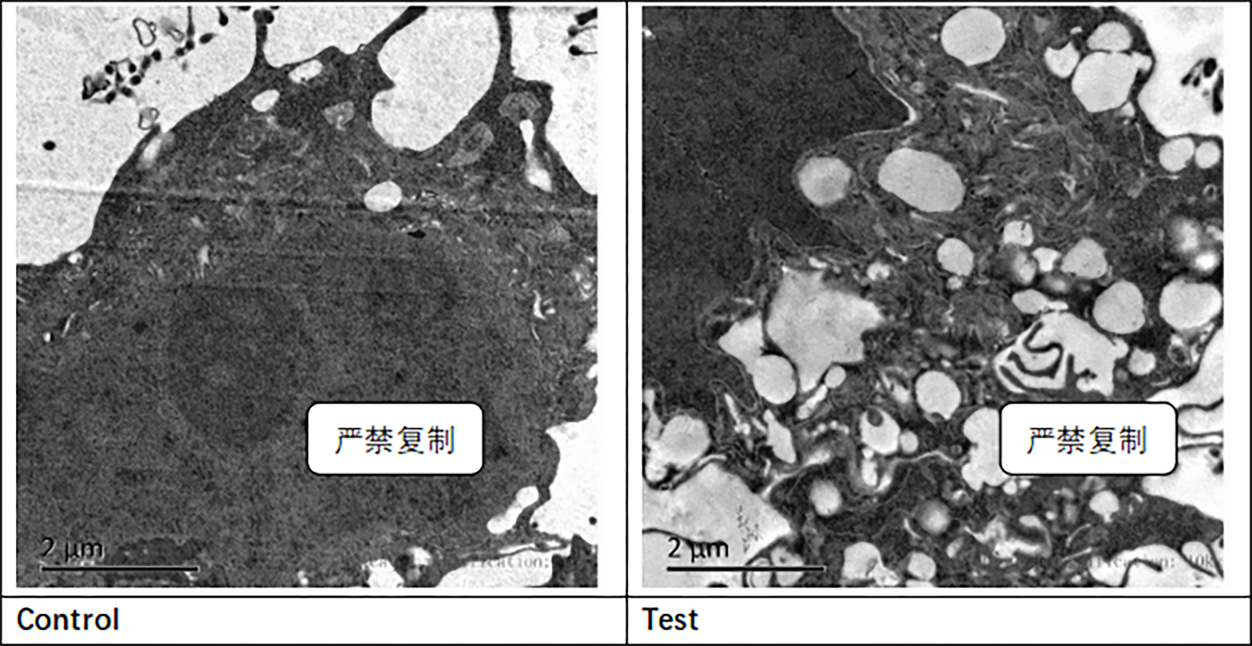
电镜观察—自噬研究最直观的检测手段。
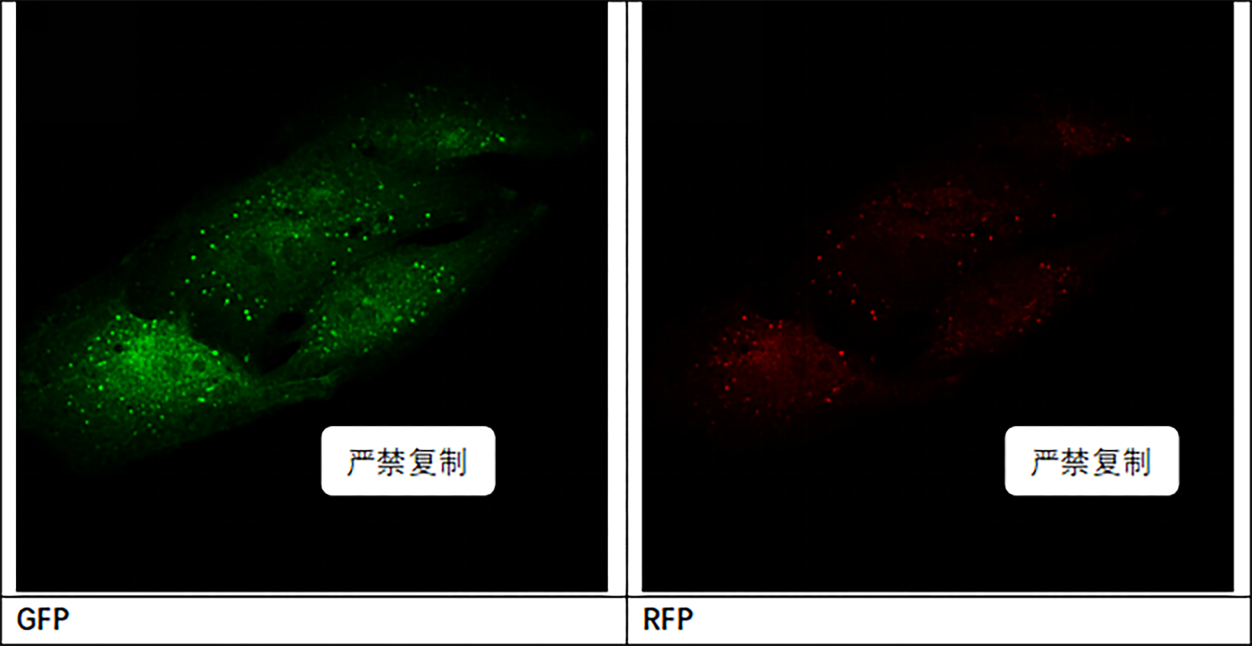
RFP-GFP-LC3自噬双标腺病毒 。

MDC自噬染色 — 自噬酸性囊泡的着色

LC3- I(包浆型)到LC3- II(自噬体膜型)的转换
